创投观察 | 疫苗生产行业研究报告
本文是创投观察系列的第162篇
分享人: 探针资本(微信公众号:Probevc) 黄珊、李丹
原文:《探针资本行业研究:疫苗生产行业研究报告(一)》、《探针资本行业研究:疫苗生产行业研究报告(二)》
一、疫苗简介
1. 疫苗定义及分类
疫苗指用各类病原微生物制作的可使机体产生特异性免疫的生物制剂,通过疫苗接种使接受方获得免疫力。近年来,随着科学技术的进步,疫苗也从传统的预防型疫苗扩展出了治疗型疫苗,如肿瘤疫苗,已在探针资本《mRNA个性化肿瘤疫苗行业研究报告》中涉及。本文将集中探讨传统预防型疫苗的行业格局。
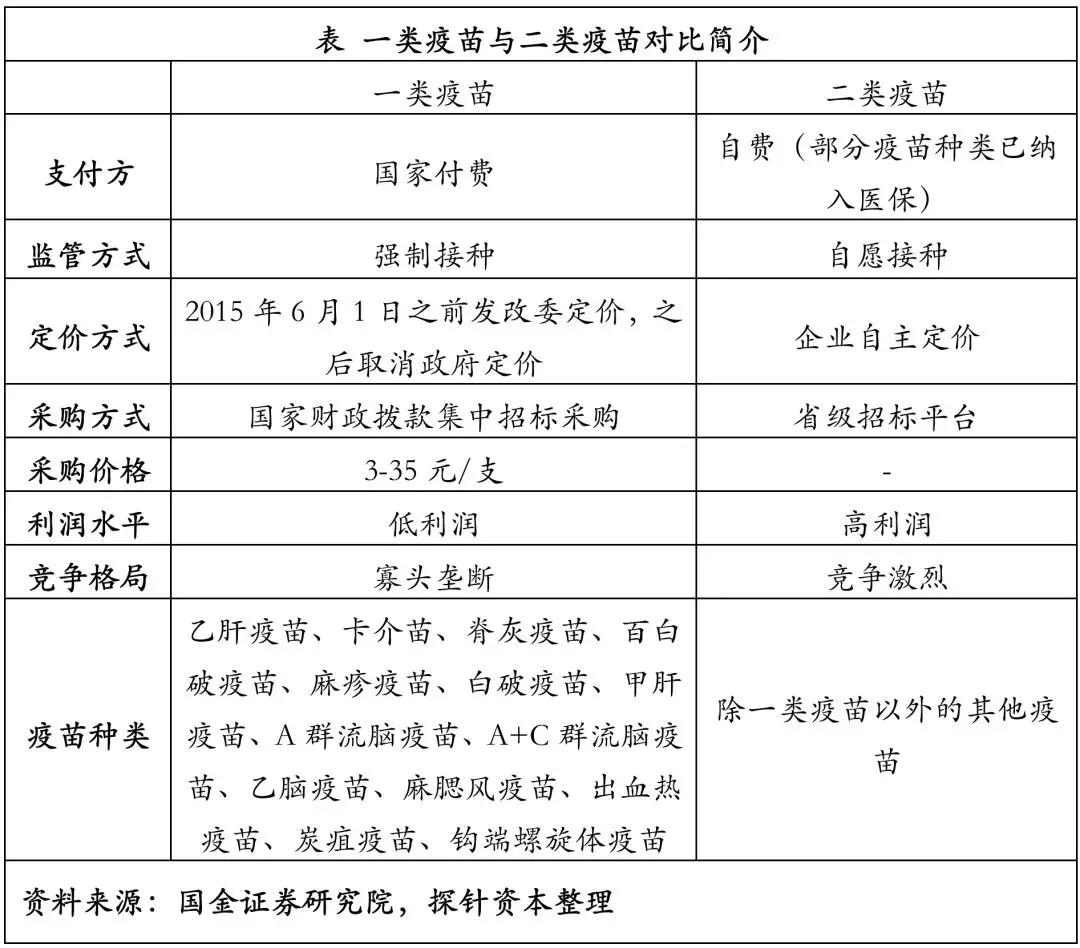
传统预防型疫苗(以下简称“疫苗”)常被分类为一类疫苗和二类疫苗。一类疫苗由国家免费提供,强制接种,目前有卡介苗(BCG)、百白破、乙肝疫苗等 14 种疫苗预防15种疾病,覆盖率超过 90%。二类疫苗是除一类疫苗以外的其他疫苗,由公民自愿、自费接种,部分纳入医保。
疫苗大部分用于感染性疾病,这些感染性疾病虽然发病率不高,但一旦发病,死亡率极高。例如,狂犬病一旦发病,死亡率达95%以上。疫苗通过刺激人体免疫系统产生免疫反应,并形成免疫记忆来保护机体,一旦病原体入侵,则会根据记忆产生相应抗体来保护机体。
接种疫苗能大幅度减少医疗费用的支出。根据美国CDC报告,美国2009年儿童基础疫苗的总费用支出为75亿,但却减少了688亿美元的疫苗费用支出。
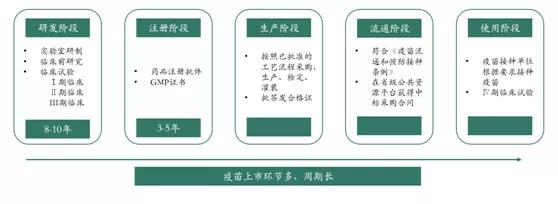
2. 疫苗上市流程
疫苗上市主要经历5个阶段,即研发阶段、注册阶段、生产阶段、流通阶段和使用阶段,整个上市流程环节多、周期长,且研发资金投入较大。
资料来源:恒大研究院,探针资本整理
2.1 研发阶段
疫苗产品的研发耗时长久,技术壁垒高,安全风险高,还需要大量研发资金投入。通常,疫苗的研发周期为8-10年。该阶段需要进行实验室研制、临床前研究及临床试验,并需先后向国家卫生监管部门进行临床研究申请。
在临床前研究阶段,毒株和细胞筛选是保证疫苗安全、有效、持续供应的基础。临床试验阶段,每期临床试验都需有严格的安全性监测和终止标准。
2.2 注册阶段
所有在研发阶段形成的资料都需递交药品监管部门以申报药品注册证。取得注册批件之后,试生产一个月,经过 CFDA 组织相关技术人员根据《药品生产质量管理规范》(GMP)对生产线进行检查合格后,才能取得GMP证书。只有两个证书都取得才能正式生产疫苗。
2.3 生产阶段
按照批准的工艺流程进行生产,每批疫苗生产出后,需要送到中国食品药品检定研究院(中检院)进行批签发,如果检验合格,则颁发批签发合格证,产品可上市销售。
中检院对疫苗产品的批签发制度指对国内出厂或国外进口的疫苗制品进行强制性地检验和审核,如果检验不合格或者审核没批准,不得上市或进口。强制性检验审核主要针对疫苗的安全性和有效性指标。中检院对企业报请批签发的每批疫苗都要通过资料审核、现场核实和样品检验等方式进行安全性检验。有效性指标的审核方面,由于检测耗时太长而疫苗有效期较短,则按照国际通行的做法,从流通环节随机抽取5%进行检验。
我国自2006年1月1日起,全面开始对每批上市疫苗实施批签发制度。CFDA主管全国生物制品的签发,负责规定批签发的品种范围、制定批签发机构、指导批签发工作的实施等。具体的批签发工作由中检院和经CFDA授权的7个省级药品检验机构负责。
2.4 流通阶段
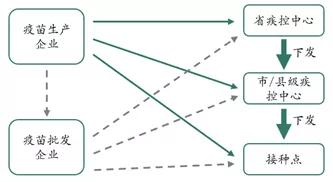
疫苗的流通过程分为一类疫苗流通过程和二类疫苗流通过程。我国一类疫苗全部由省级卫生计生行政部门进行集中招标采购,逐级进行分发、配送。
二类疫苗流通过程主要有两次重要改革。2005年之前,我国二类疫苗流通过程和一类疫苗流通过程相同,疫苗流通没有市场化。

资料来源:CDC官网,探针资本整理
2005年,《疫苗流通和预防接种管理条例》实施,该条例规定,符合条件的疫苗流通企业可以经营二类疫苗。同时,疫苗生产企业可以直接向疾病预防控制机构、接种单位、疫苗批发企业销售本企业生产的第二类疫苗。
资料来源:CDC官网,探针资本整理
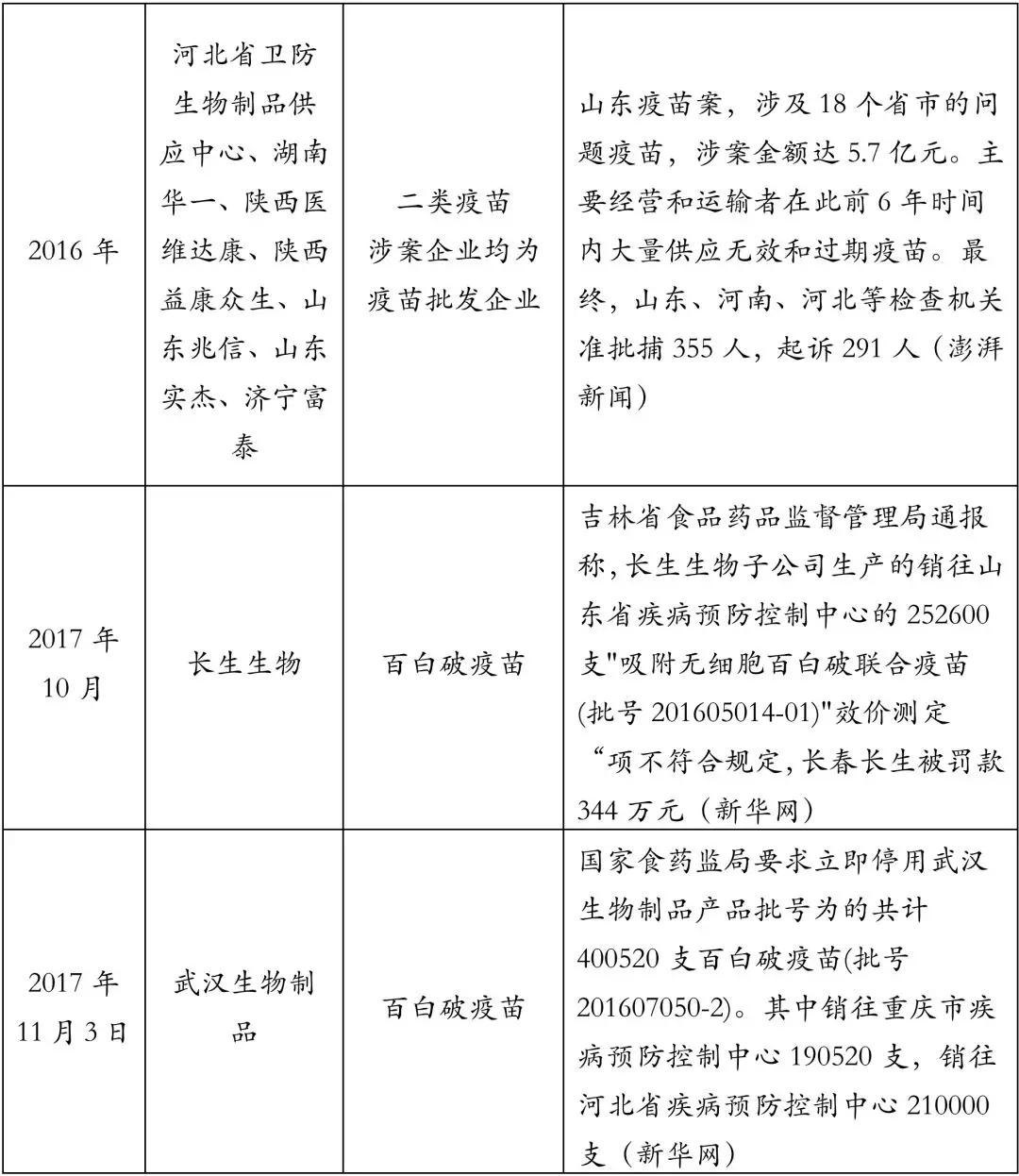
2016年3月份,山东爆出毒疫苗案,高达5.7亿人民币的疫苗没有经过严格的冷链运输销往24个省市,涉及25种儿童、成人用二类疫苗。
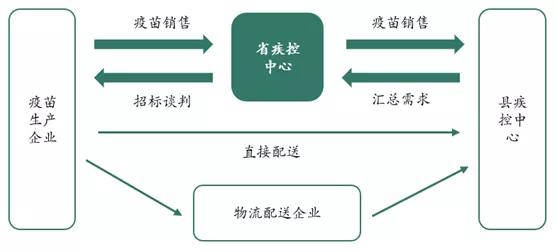
同年4月,国务院通过《国务院关于修改〈疫苗流通和预防接种管理条例〉的决定》,该条例对二类疫苗的流通进行了全面的整治和规范,规定取消疫苗批发企业销售疫苗的资格,将疫苗的采购全部纳入省级公共资源交易平台。
县疾控中心汇总需求上交至省疾控中心,省疾控中心通过该平台组织全省集中采购,确定中标的生产企业、品种、规格和价格,之后县疾控中心与中标企业签订采购合同。生产企业只能通过省级交易平台将疫苗销售给县疾控中心,同时需要直接或者委托配送,配送环节要求全程冷链运输。此次改革使得疫苗行业开始实施高开一票制。
资料来源:CDC官网,探针资本整理
2.5 使用阶段
该阶段涉及Ⅳ期临床研究,目的是考察疫苗在大面积人群使用的安全性和有效性。
二、政策环境分析
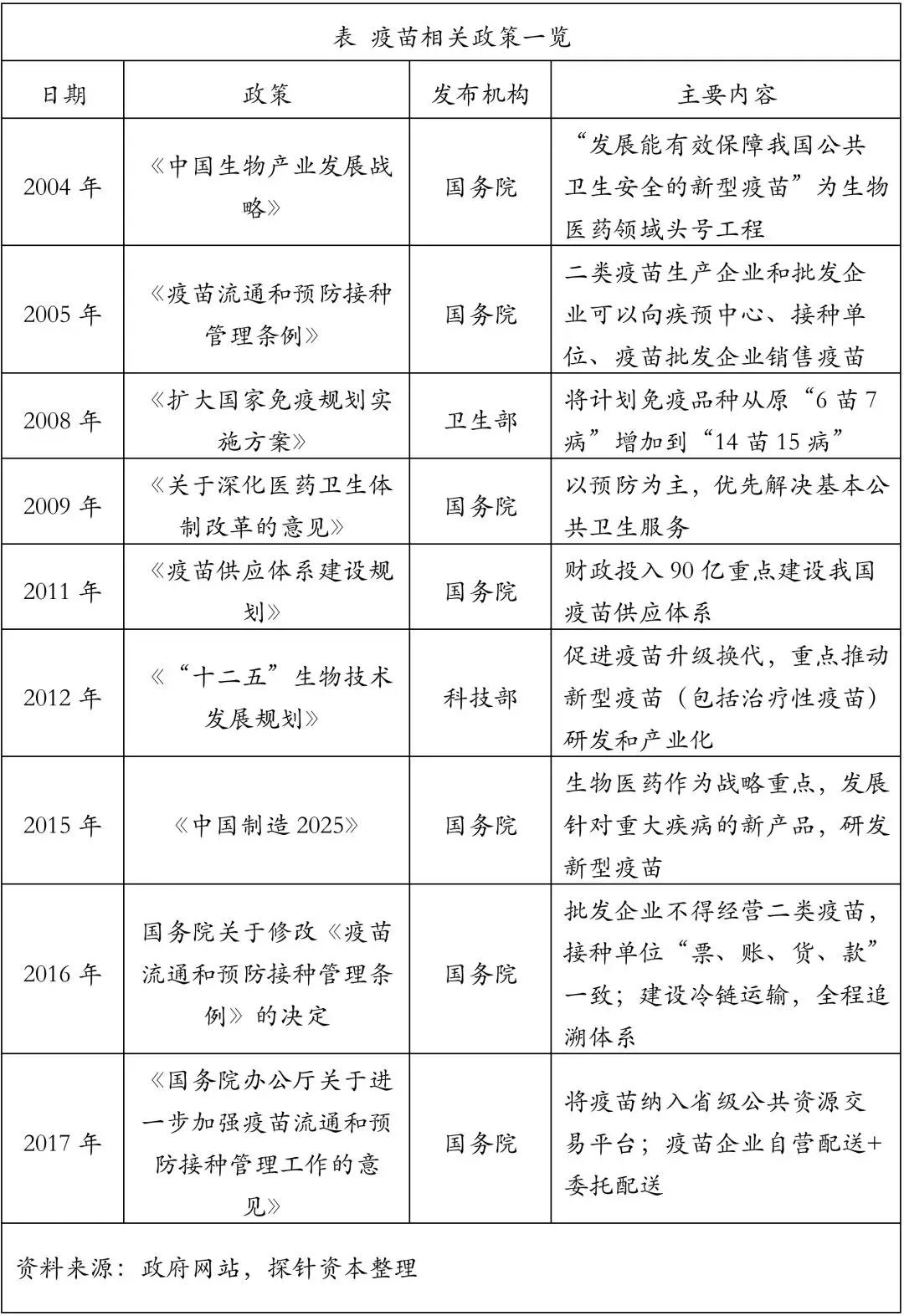
1. 政策概览
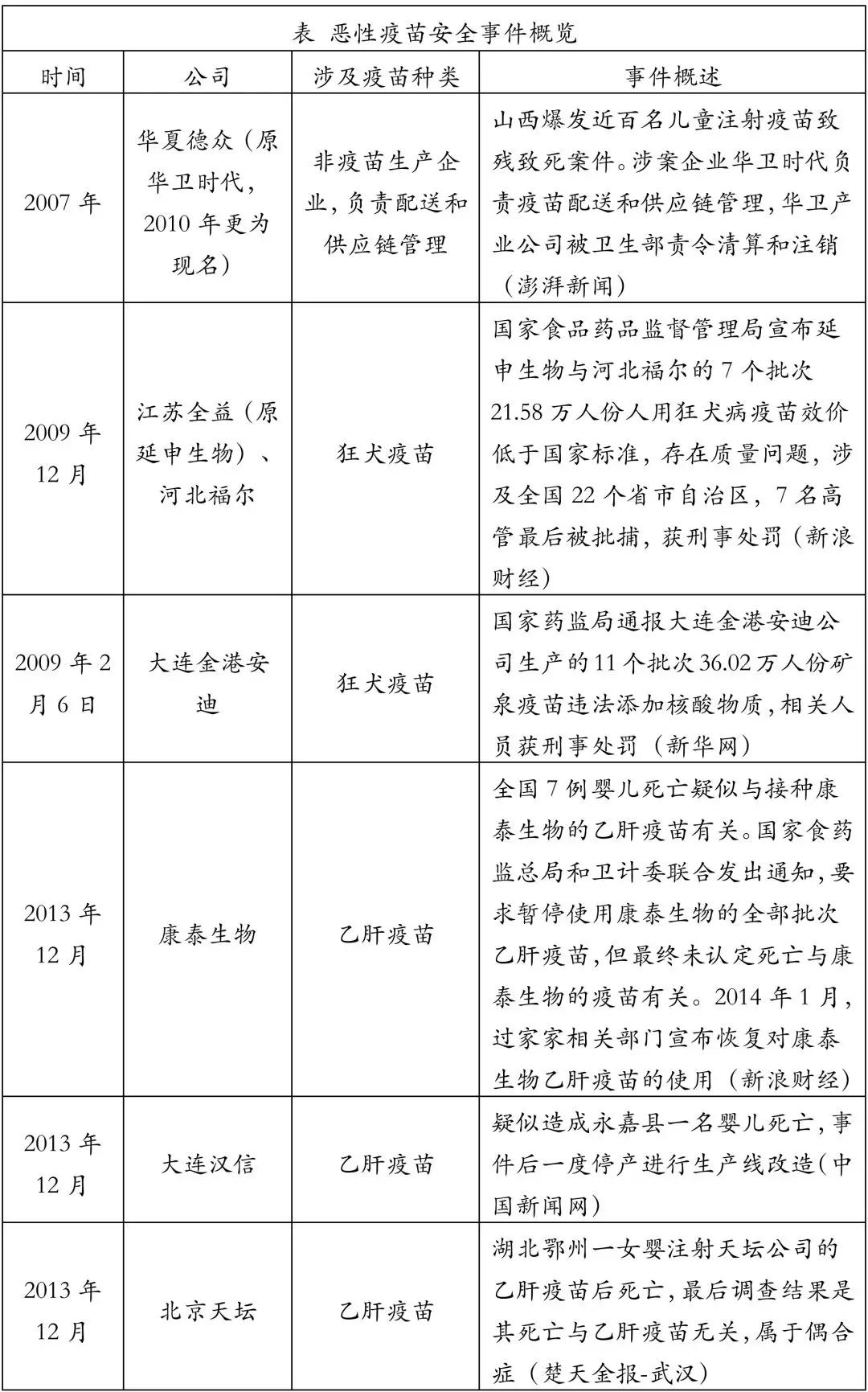
2. 恶性疫苗安全事件概览
从2004年至2017年,国务院连续出台文件,规范了疫苗生产流通和预防接种环节的各项标准与管理指南。然而,即使立法文件已经细致到各环节的方方面面,由于巨大的利益驱使和监管环节的疏漏,恶性疫苗安全事件依然层出不穷。
3. “长生生物”事件概览
今年发生的“长生生物”事件是当前最引人注目的恶性疫苗安全事件。
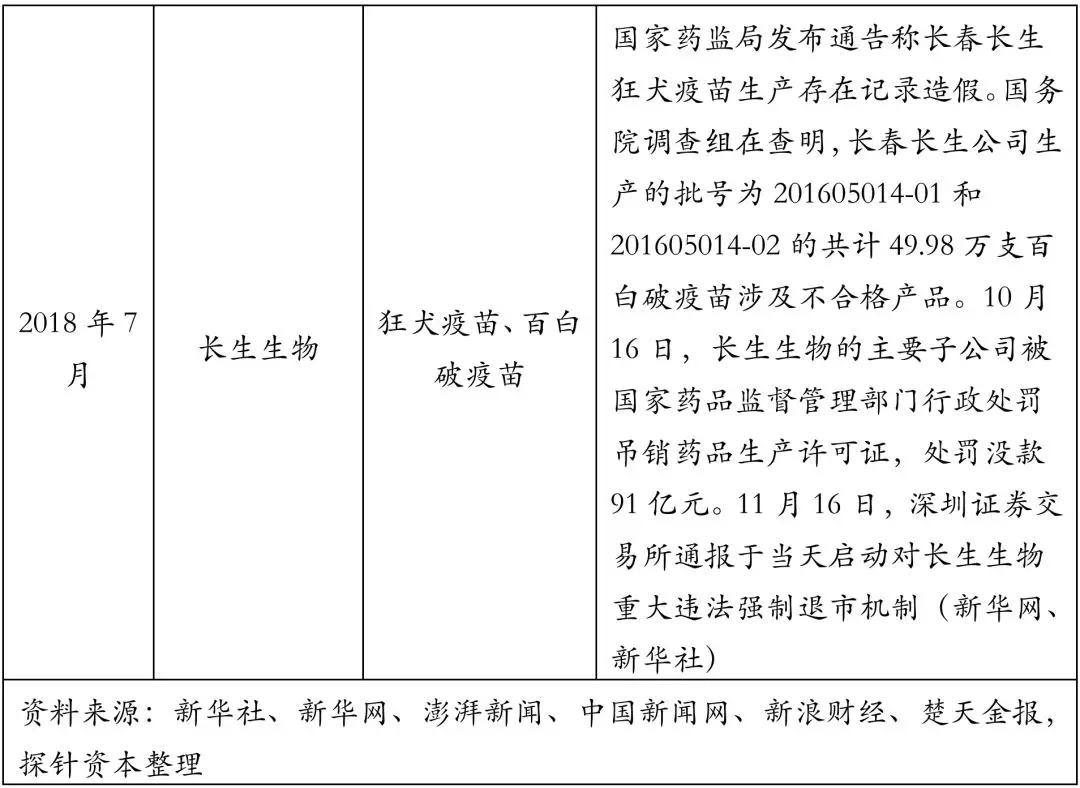
2018年7月15日,国家药品监督管理局通告长春长生生物科技有限公司的冻干人用狂犬病疫苗的生产存在记录造假行为,迅速引发全国舆论。
7月19日,长生生物发布公告称,其子公司长春长生生物科技有限责任公司收到了《吉林省食品药品监督管理局行政处罚决定书》。其生产的“吸附无细胞百白破联合疫苗”(批号:201605014-01),经中国食品药品检定研究院检验,检验结果“效价测定”项不符合规定,存在质量问题。
7月20日,《疫苗之王》文章在微信朋友圈刷屏,事件发酵。21号,舆论爆发,引起全社会,特别是家长群体的广泛关注,致使严重的社会恐慌与信用感缺失。
7月23日,国家主席习近平与国务院总理李克强对吉林长春长生生物疫苗案件作出重要指示,国务院建立专门工作机制,派出调查组进驻长春长生生物科技有限责任公司进行立案调查。
7月25日,国家药监局整合2018年年初调查收集的全国45家疫苗生产企业相关数据,对全部疫苗生产企业进行全流程、全链条彻查,涉及原辅料、生产、检验、批签发等各个方面。同日,国务院调查组赴吉林开展长春长生违法违规生产冻干人用狂犬病疫苗案调查工作。
7月31日,长生生物发布公告称,除百白破联合疫苗、冻干人用狂犬病疫苗产品被责令停产外,公司决定对其他产品也采取全面自主停产,以上生产车间在停产期间自查自纠,进行全面、彻底的整改。
8月15日,新华社发布消息称,国务院调查组在对长生生物调查中进一步查明,长生生物的百白破问题疫苗不止批次为201605014-01的25.26万支疫苗,还涉及批次为201605014-02的24.72万支疫苗,共计49.98万支。
8月16日,国务院总理李克强主持召开国务院常务会议,听取了长生生物案件长生生物并作出相关处置决定。会议决定没收长春长生公司所有违法所得并处最高罚款,并对包括吉林省副省长金育辉在内的41名涉事干部进行问责。
9月19日,吉林省高新技术企业认定管理机构决定自2017年度起取消该公司的高新技术企业资格。
10月16日,国家药品监督管理局和吉林省食品药品监督管理局对长生生物违法违规生产狂犬病疫苗作出行政处罚,决定撤销长生生物狂犬病疫苗(批号: S20120016)药品批准证明文件、撤销涉案产品生物制品批签发合格证、吊销长生生物《药品生产许可证》、没收违法生产的疫苗、罚没共计91亿元款项;对14名责任人进行行政处罚;制定接种者的赔偿方案。
2018年11月16日,深圳证券交易所通报于当天启动对长生生物重大违法强制退市机制。
三、市场分析
1. 国际市场格局
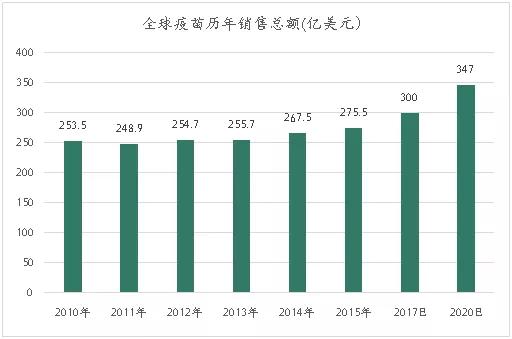
根据EvaluatePharma预测,2015年疫苗行业市场规模约275.5亿美元,占全球药品市场的3.4%,年均复合增速约2.8%,预计2020年全球疫苗市场年销售总额将达到347亿美元。
数据来源:EvaluatePharma 2015,探针资本整理
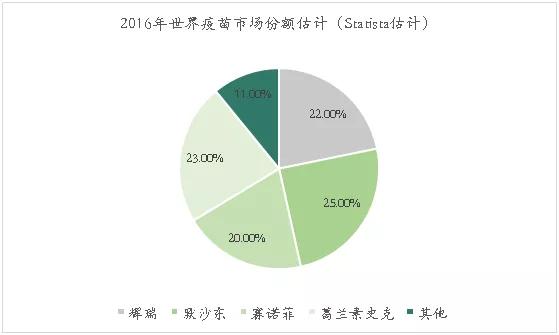
全球疫苗行业呈现寡头竞争状态,葛兰素史克、赛诺菲、默沙东和辉瑞四大巨头总计占据全球疫苗市场的90%左右。
数据来源:东吴证券研究所,探针资本整理
2016年全球销售额前十大重磅疫苗全来自四大巨头,其中默沙东最多有4个,赛诺菲2个,葛兰素史克3个,辉瑞1个。
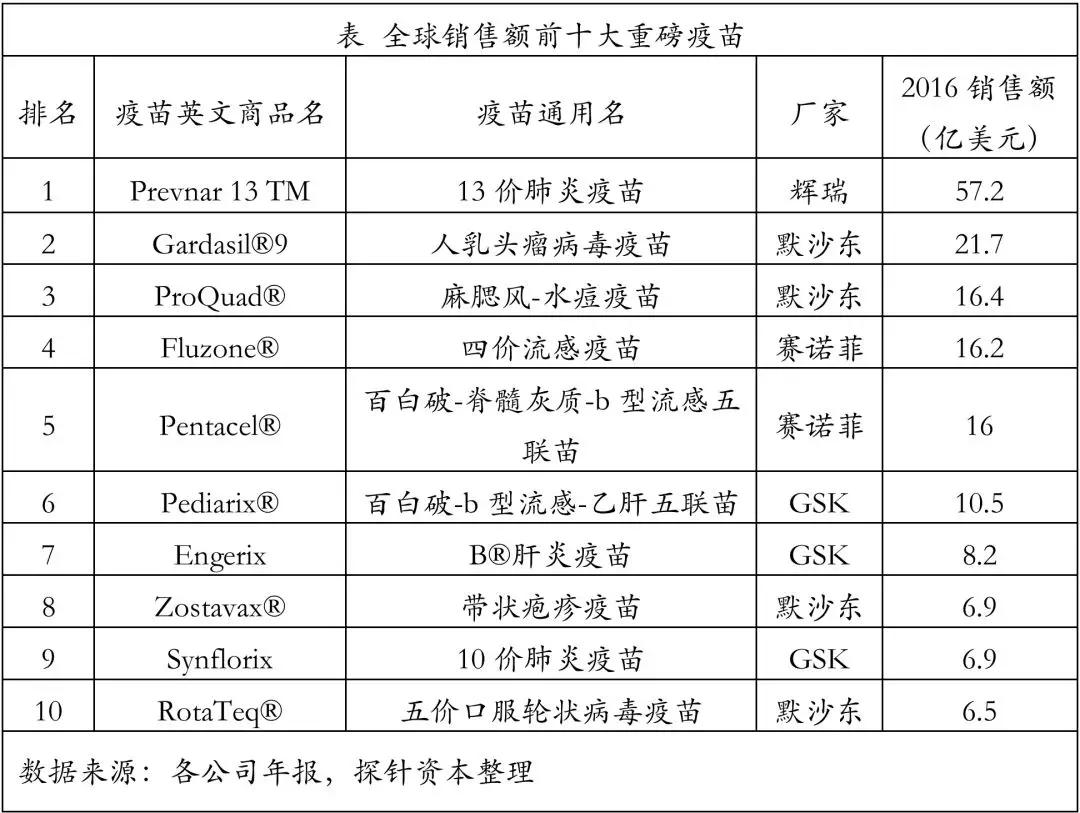
从品种上看,国际市场主要疫苗品种为呼吸系统疫苗、HPV疫苗、水痘和带状疱疹等。其中,包括抗肺炎球菌疫苗、百白破疫苗、抗脑膜炎球菌疫苗和流感疫苗等在内的呼吸系统疫苗占比最大,为63%。
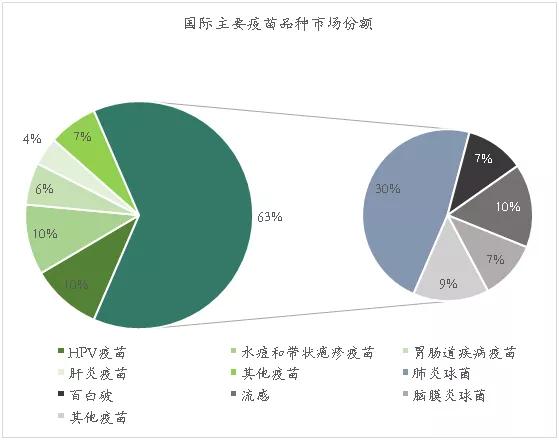
数据来源:国金证券研究所,探针资本整理
2. 国内市场格局
2.1 国内市场概况
我国是疫苗生产第一大国。出于庞大的人口基数,自2010年以来,我国的年批签发量维持在5亿至10亿瓶/支。
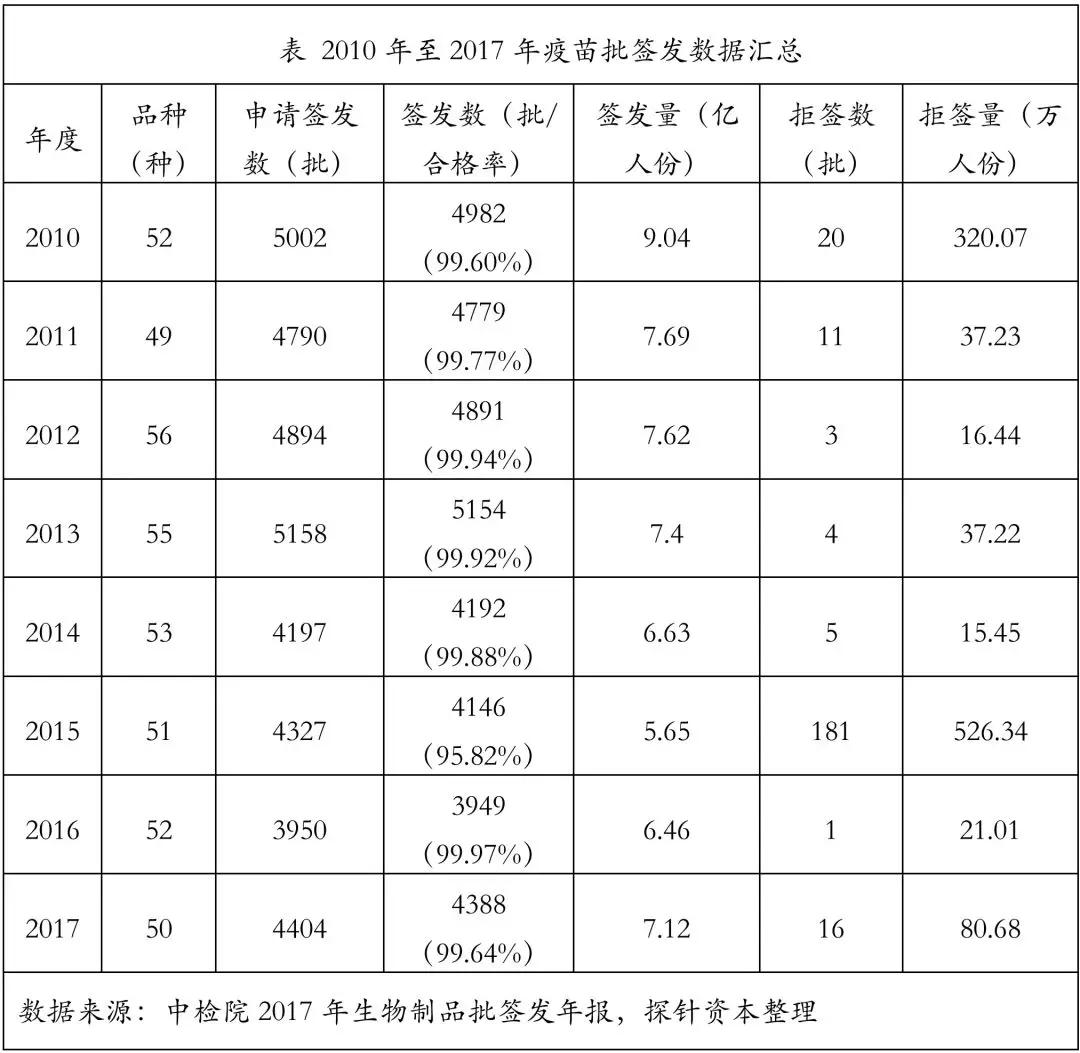
其中95%以上为国产疫苗,进口疫苗占比较小。2017年,申请疫苗批签发的境内企业有39家共4237批,约6.94亿人份;境外企业有6家共 151批,约0.18亿人份。申请批签发疫苗共50个品种。国有企业是一类疫苗的供应主体,民营企业产品主要供应二类疫苗。
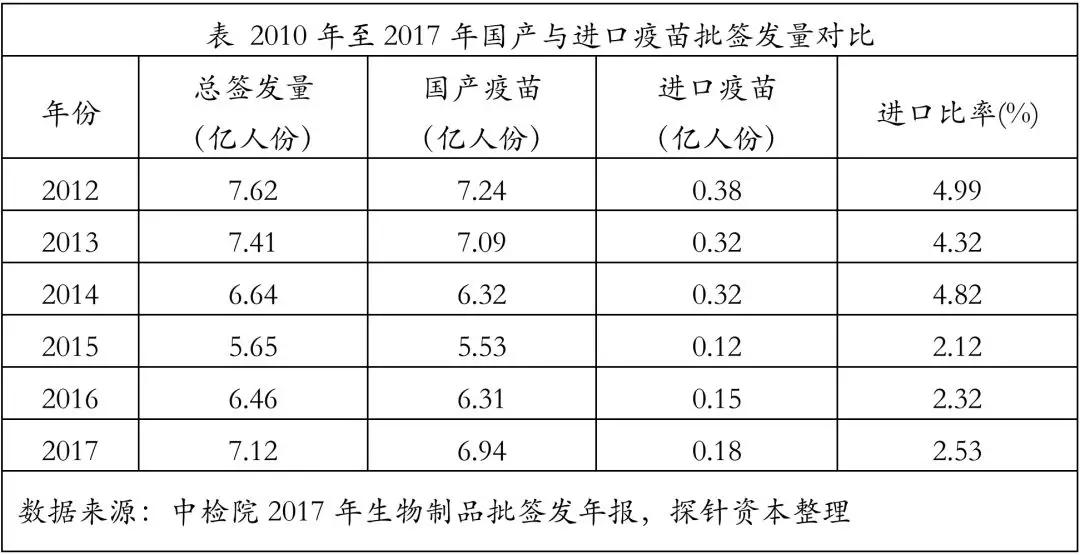
我国进口疫苗占比极少,2017年进口疫苗批签发量仅占比2.53%,共涉及默沙东、葛兰素史克、凯荣-贝林、赛诺菲巴斯德、国光生物和辉瑞爱尔兰六家公司,共计11个品种。进口疫苗占比较少的原因主要是因为我国严格的疫苗监督管理体系。
根据我国《药品注册管理办法》规定,进口疫苗在国内批准上市之前,需开展临床试验,经过1-5年的审评时间,才能拿到《进口药品注册证》。注册证5年续期一次,一旦过期,将面临续期被终止的风险。同时,进口企业不仅需要拿到注册证,还需符合《中国药典》要求,且该《药典》5年修订一次。2010年10月,《药典》对疫苗中的抗生素残留量和Vero细胞DNA残留量提出了更高要求,大幅提高了疫苗质量准入门槛,导致进口疫苗数量由总批签发量的约10%下降至2011年的4%左右。
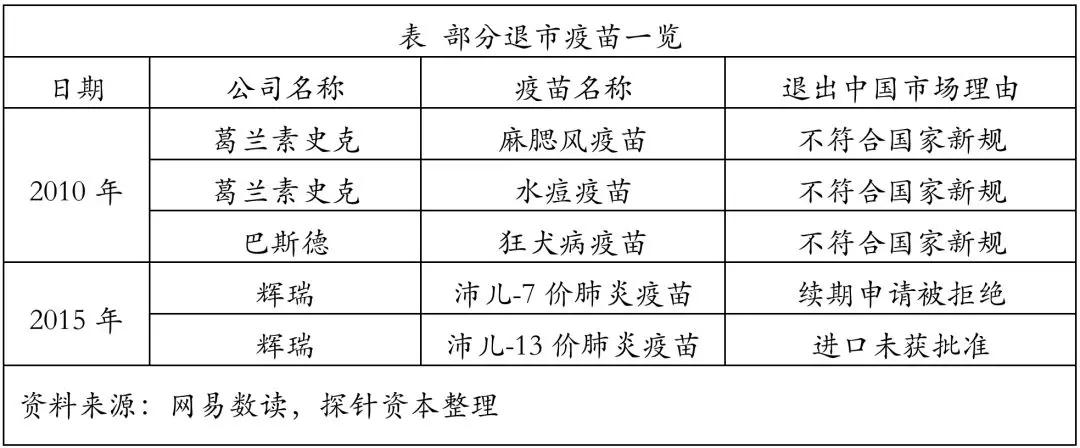
根据恒大研究院任泽平报告,2015年我国疫苗产业市场规模从2005年的65亿元增至245 亿元,年均复合增长率达14%。因此,若维持此增长率,可预期2020年中国疫苗市场规模将达到472亿元。
其中,一类疫苗市场市场趋于饱和,增速较慢。二类疫苗市场随着近年来一些新型疫苗的获批上市以及传统疫苗升级换代为多联苗,仍有增长空间。
2.2 一类疫苗市场
2017年,签发上市的一类疫苗约计5.61亿人份,占上市疫苗的 78.79%,由于一类疫苗为国家医保付费的福利性质产品,且强制接种,因此价格和利润率都有限。行业内疫苗生产商主要以国企为主,市场集中度较高,其中中生集团下的六大所(北京生物制品研究所、长春生物制品研究所、成都生物制品研究所、兰州生物制品研究所、上海生物制品研究所和武汉生物制品研究所)及昆明所(中国医学科学院医学生物研究所)市场份额总计80%左右。
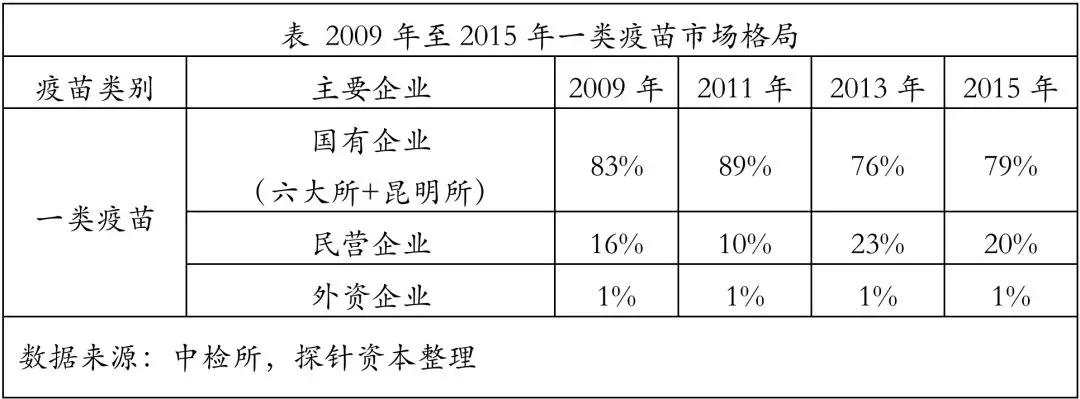
2017年,疫苗批签发最多批次的企业是武汉生物制药研究所,共签发了7个品种,共计466个批次。
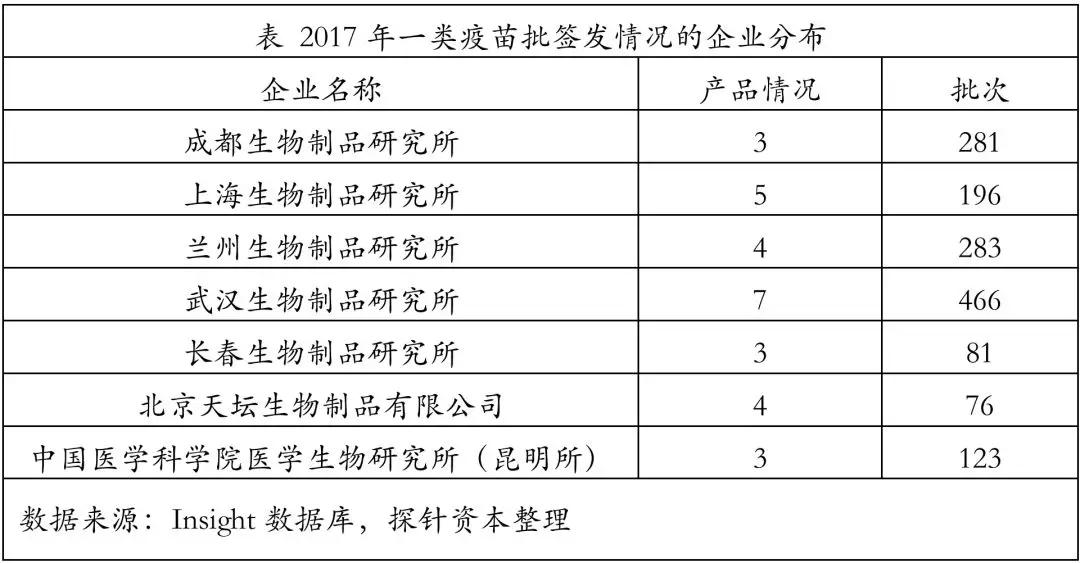
我国2017年的一类疫苗市场份额方面,百白破疫苗签发量占据第一,约1.05亿支,占到今年疫苗签发总量的17.54%,主要由武汉生物制品研究所、长生生物和玉溪沃森供应,其中80.53%的市场份额由武汉生物制品研究所占据。
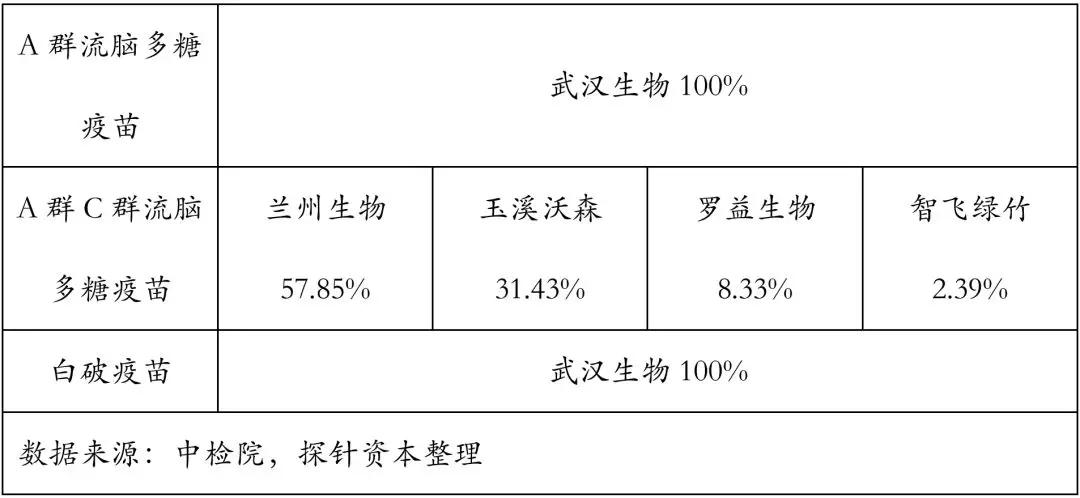
一类疫苗分别在 1992、2008、2016年有过三次增补,目前共有卡介苗(BCG)、百白破、乙肝疫苗等 14 种,覆盖率均超过 90%以上,许多疫苗的覆盖率达95%以上。由于市场趋于饱和,近年来,一类疫苗批签发量呈下降趋势。
2018年7月,“长生生物“事件爆发,随后其主要子公司被国家药品监督管理部门行政处罚吊销药品生产许可证。本来由长生生物占据的18.85%百白破疫苗和17.06%甲肝减毒活疫苗市场很大程度上将会受到影响。
2.3 二类疫苗市场
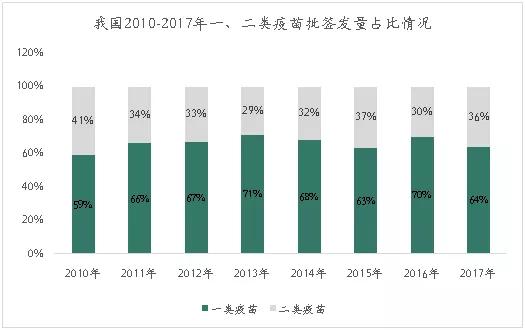
我国疫苗市场主要以一类疫苗为主,二类疫苗市场份额比较波动,但长远看来呈现波动上升趋势。
2015年二类疫苗批签发量占总批签发量的37%。2016年,受山东疫苗事件影响,二类疫苗批签发量占比下滑至30%。山东疫苗事件后,国家开始对疫苗行业实施一票制,减少中间流通环节,政策改革使得二类疫苗市场逐渐恢复,2017年二类疫苗批签发量占比提高至36%。
数据来源:中检院,探针资本整理
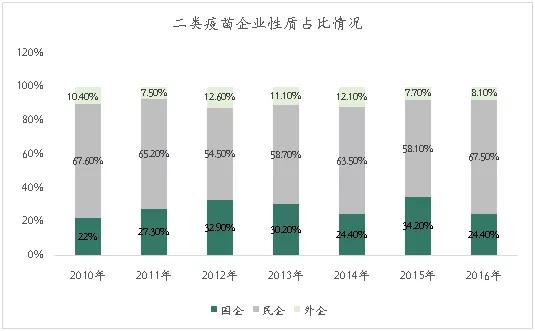
我国二类疫苗是自费接种,比一类疫苗的毛利更高,主要参与者为民营企业。2016年,民营企业占比67.5%,国企仅占24.4%,其余8.1%由各大外企组成。
数据来源:中检院,探针资本整理
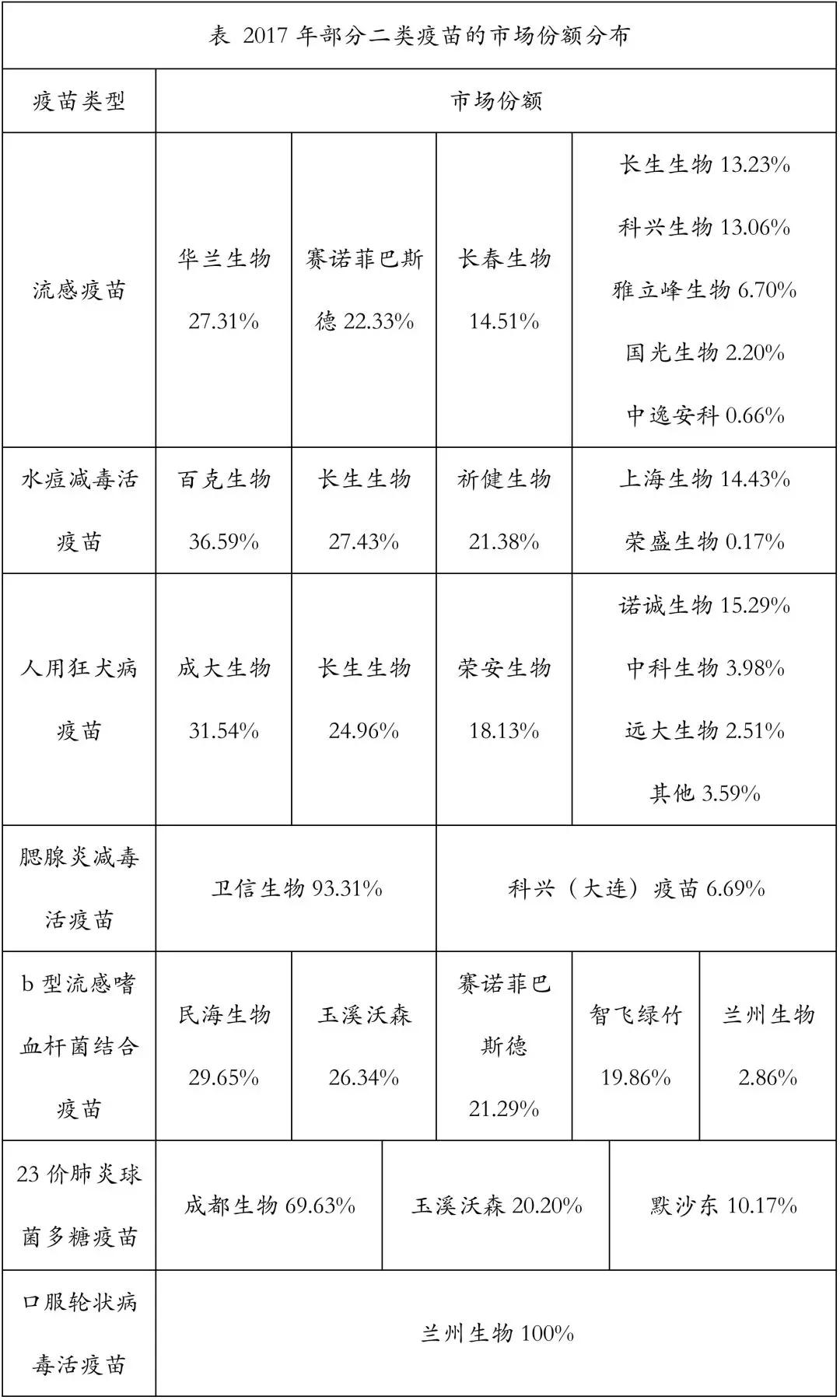
据中检院数据,2017年二类疫苗签发的品种主要有流感疫苗、狂犬疫苗、b型流感嗜血杆菌结合疫苗、水痘疫苗、肺炎疫苗和 EV71灭活疫苗等。二类苗成熟品种如狂犬疫苗、流感疫苗、水痘疫苗等传统二类苗同质化竞争激烈。随着新型疫苗(13价肺炎结合疫苗、HPV疫苗等)陆续获批以及四价流感疫苗、人二倍体细胞狂犬疫苗、五价口服轮状病毒疫苗以及联合疫苗等升级换代产品的出现,国内二类苗市场迎来新的增长点。

2.4 二类疫苗:狂犬疫苗市场
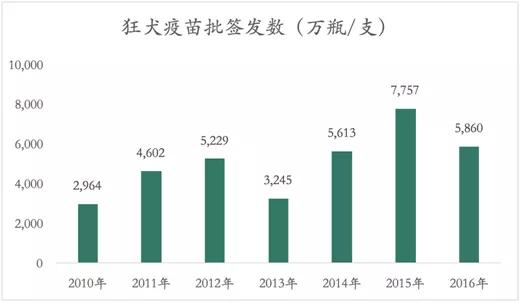
狂犬疫苗是竞争较为激烈的二类疫苗。狂犬病是致死人数最多的动物源传染性疾病,全球每年约6万人死于该病。目前,99%的狂犬病发生于亚洲、非洲和拉丁美洲等发展中国家,印度是全球狂犬病例数最多国家,发病率约为2/10万,我国狂犬病发病数仅次于印度。
中国 CDC 狂犬病指南数据显示,2007年疫情高峰期时,年报告病例达到3300例。2004年至2014年,狂犬病死亡人数一直高居我国传染病死亡数的前3位。2007年疫情高峰后,我国加强了狂犬病的防治和疫苗的推广,随后狂犬病发病数逐渐下降,2014年已下降到1000例以下。
数据来源:中检院,探针资本整理
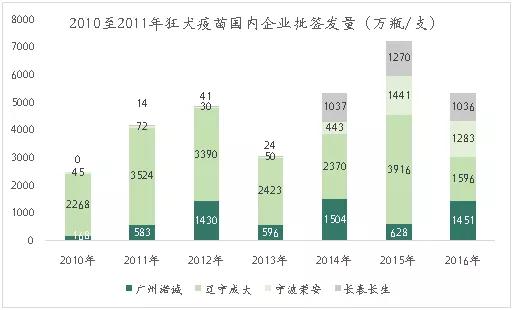
目前市场上的狂犬疫苗生产企业主要是广州诺诚、辽宁成大、宁波荣安和长春长生等四家,2017年总计批签发量为5365万瓶/支,占狂犬疫苗总批签发量的91.6%。
数据来源:中检院,探针资本整理
2.5 二类疫苗:水痘疫苗市场
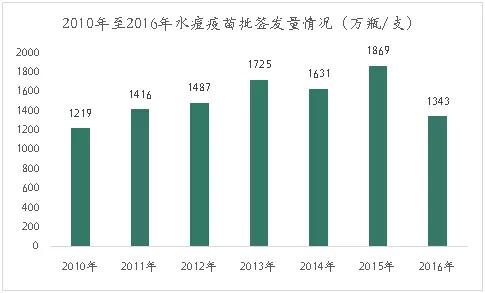
水痘疫苗是主要针对水痘-带状疱疹病毒初次感染引起的急性传染病的预防型疫苗。水痘的传染性极强,通常通过呼吸道飞沫或直接接触传染,主要发生在婴幼儿和学龄前儿童身上,发病率可达95%以上。
目前,国内大部分地区的接种率已经达到 80%-90%,每年市场增加主要是新生儿以及两针法的普及带来的增量市场。根据批签发数据,水痘疫苗 2010-2015 年呈现良好的增长态势,2016年受山东疫苗事件影响,导致疫苗批签发量大幅下降至1343万瓶/支。
数据来源:中检院,探针资本整理
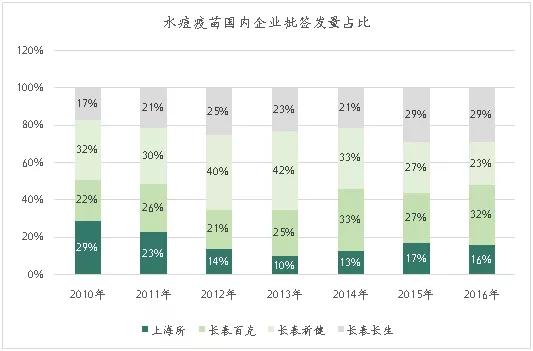
国内水痘疫苗生产企业主要有上海所、长春百克、长春祈健和长生生物四家,其中,长春百克市场份额最大,2017年占比32%。
数据来源:中检院,探针资本整理
2.6 二类疫苗:EV71灭活疫苗市场
EV71灭活疫苗主要用于预防由肠道病毒71型(Enterovirus type 71,EV71)感染引起的手足口病。该病在3岁以下婴幼儿中发病率最高,少数病例(尤其是小于3岁者)病情进展迅速,在发病1-5天左右出现脑膜炎、脑炎、脑脊髓炎、肺水肿、循环障碍等,极少数病例病情危重,甚至会致死亡,存活病例可留有后遗症。
2008年至2015年,我国共报告手足口病约1380万例,平均年发病率为147 /10万,报告重症病例约13万例,死亡3300多人,2017年1至8月患病人数达126万人。
目前我国有3个企业生产EV71疫苗。2015年12月昆明所和北京科兴的产品获批上市,2016年3月和7月昆明所及北京科兴的产品分别开始批签发。2016年12月,武汉所的疫苗产品也获批上市,2017年中检所公布的批签发数据中开始有武汉所的产品。
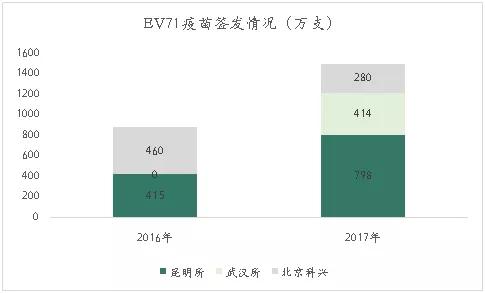
数据来源:中检院,探针资本整理
2016 年全年 EV71 疫苗的批签发量为875.5万支,其中昆明所与科兴批签发量分别为460万和415.5万支。2017年的批签发数量为1492万支,其中昆明所市占率最高,占据了53.5%。