从生命的本质治疗疾病——核酸药物空间有多广?
去年以来,全球范围内mRNA新冠疫苗的成功研发与大规模使用,使得RNA药物开始走进大众视野。实际上,在日益发展的核酸药物矩阵中,mRNA只是其中一类。随着靶点发现、技术的进步和化学修饰、递送技术的成熟,核酸药物正在快速成为一个主要的治疗板块。
当前在港股生物医药板块中,尚无一家公司专注于RNA类型药物研究。但圣诺制药的到来有望填补港股市场在专业核酸药物研发企业投资上的空白,7月15日,圣诺生物正式向港交所递交招股书申请主板上市。本文将初步探讨核酸药物的行业情况。
核酸药物直指生命本质
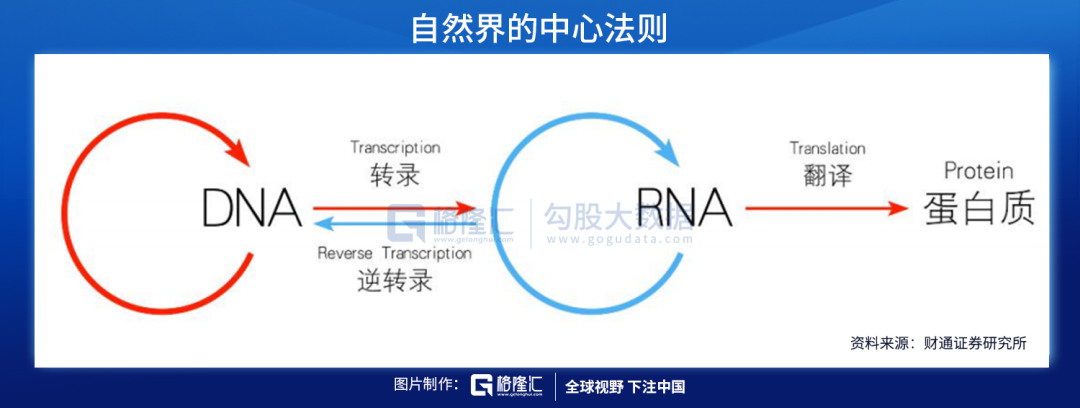
核酸是由许多核苷酸聚合成的生物大分子化合物,为生命的最基本物质之一。根据化学组成不同,核酸可分为脱氧核糖核酸(DNA)和核糖核酸(RNA)。DNA是储存、复制和传递遗传信息的主要物质基础,RNA在蛋白质合成过程中起着重要作用。
核酸药物则是各种具有不同功能的寡聚核糖核苷酸(RNA)或寡聚脱氧核糖核苷酸(DNA),能够直接作用于致病靶基因或者靶mRNA,在基因水平上发挥治疗疾病的作用,如由于基因突变可能引起某个重要功能基因的转录变化,导致相应的蛋白出现过多、过少表达或者突变,诱发特定疾病,核酸药物从转录后水平进行基因沉默或激活治疗,相比传统蛋白水平发挥作用的药物具有高特异性、高效性、长效性等明显优势。
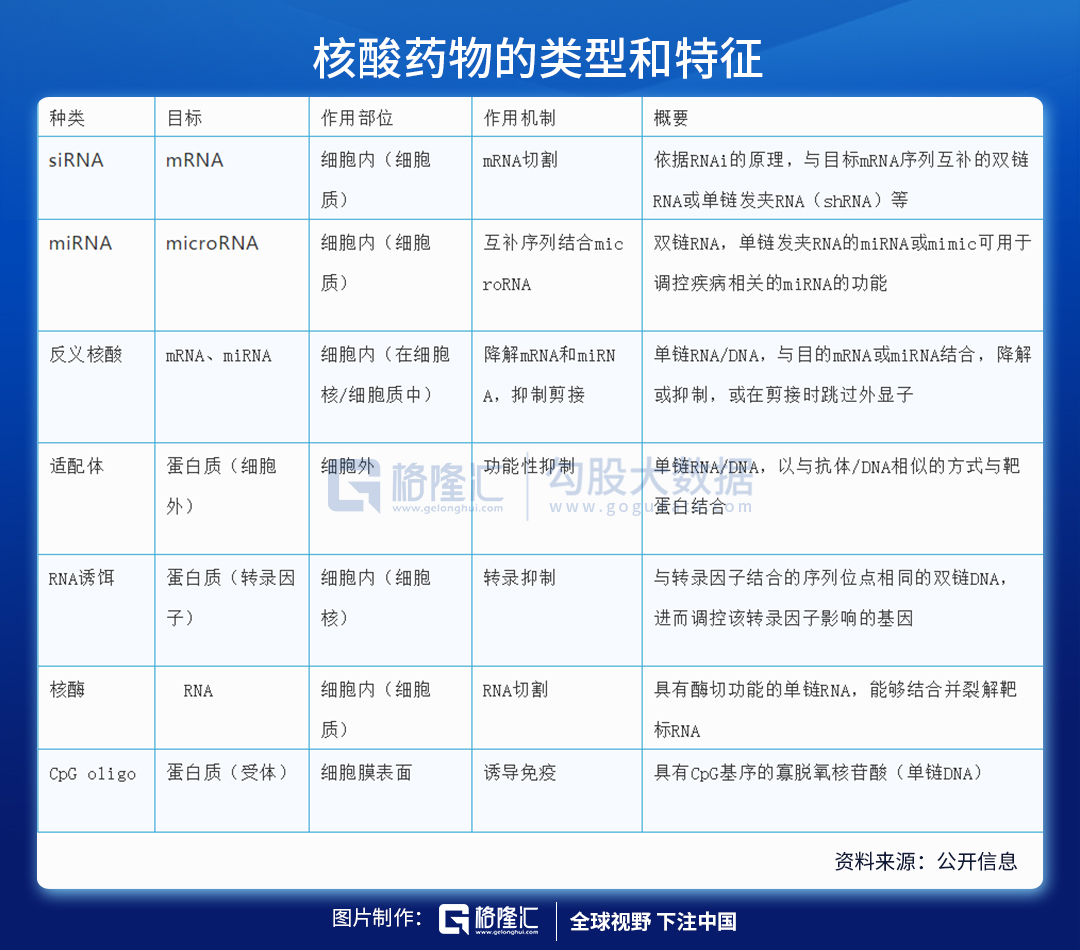
核酸药物包括反义核酸(ASO)、小干扰RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、信使RNA(mRNA)适配体(aptamer)、核酶(ribozyme)、抗体核酸偶联药物(ARC)等,是基因治疗的一种形式,也是继小分子药物、蛋白药物、抗体药物之后的新一代制药技术。
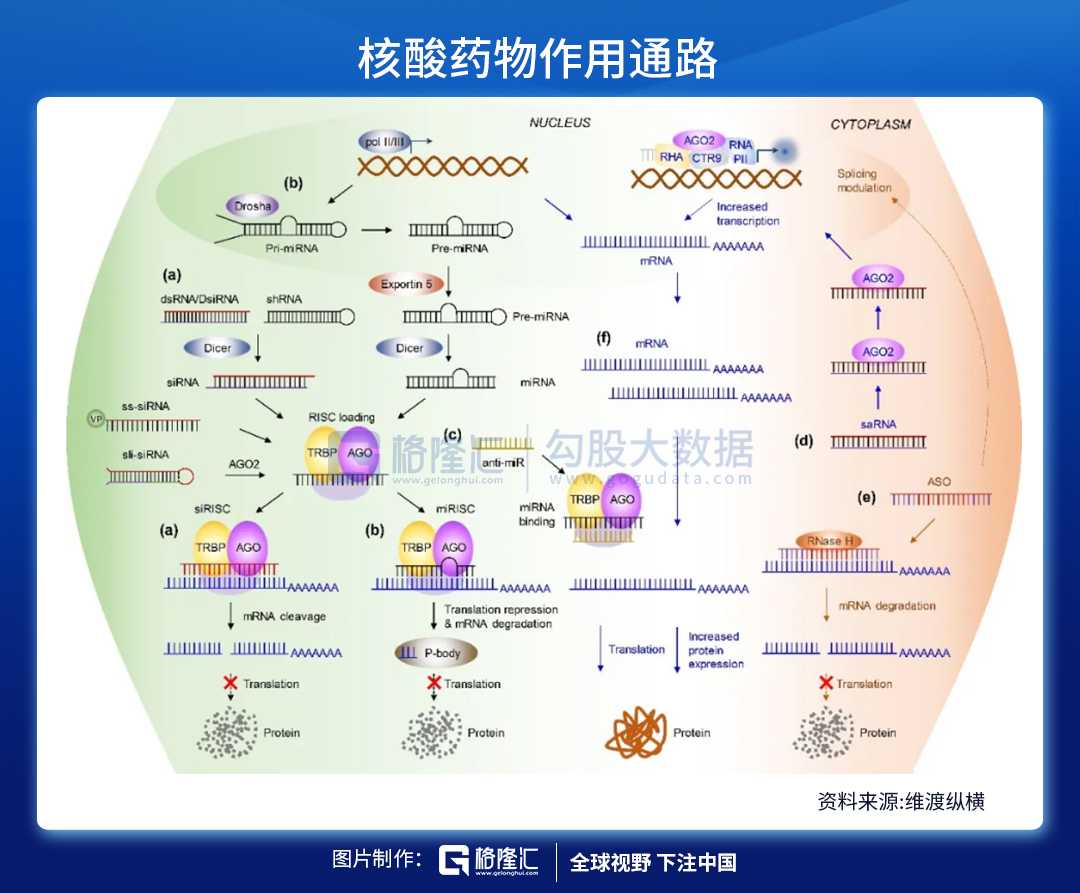
注:(a)小干扰RNA(siRNA)与(b)微小RNA(miRNA)的作用通路;(c)miRNA拮抗核酸作用机制;(d)小激活RNA(saRNA)的工作模式;(e)反义核酸(ASO)作用方式;(f)信使RNA(mRNA)疗法的特点
核酸药物可以大大提升靶点数量
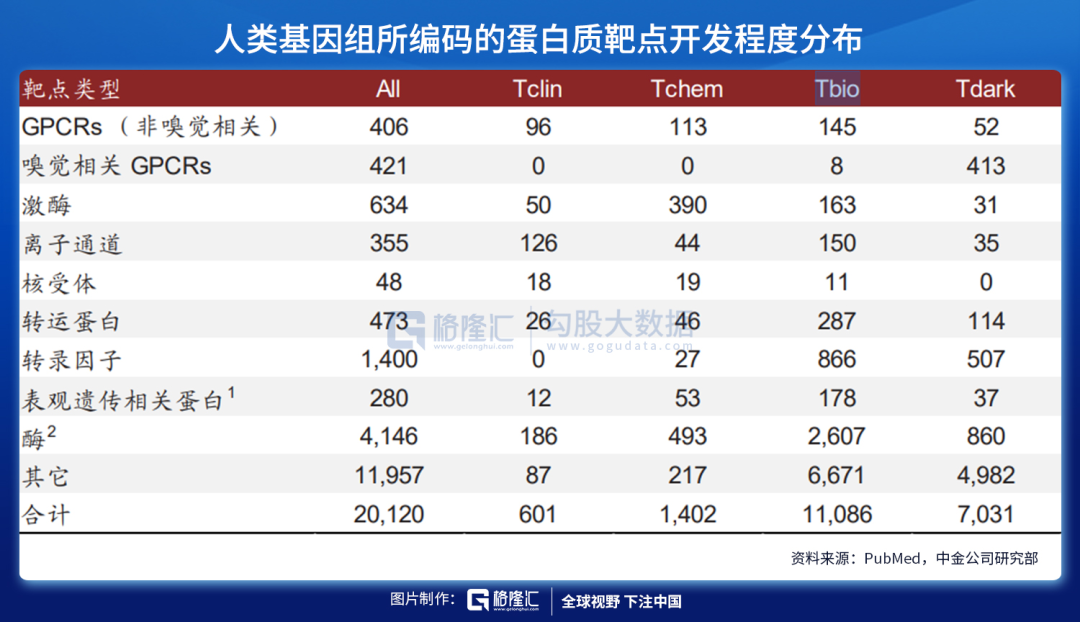
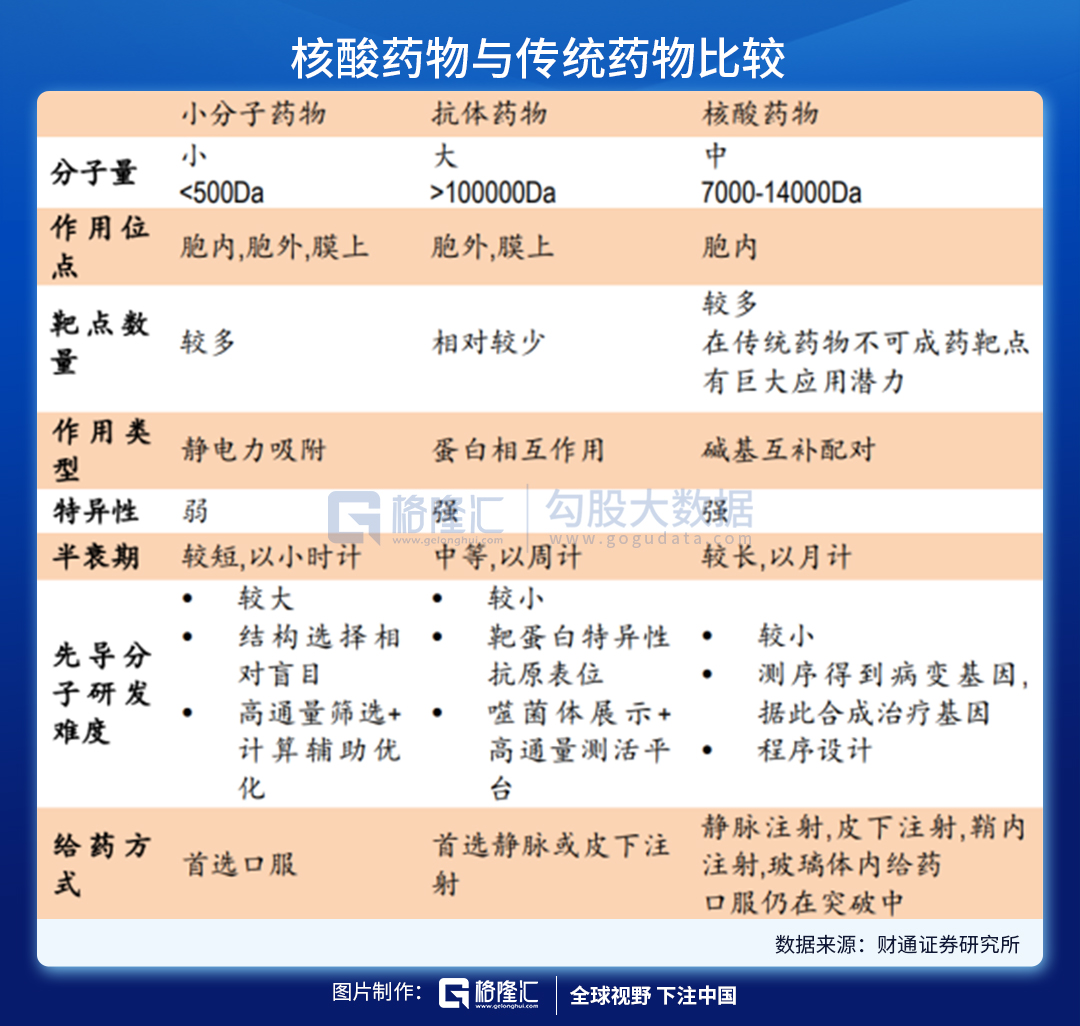
小分子化药和抗体药物通过与靶点蛋白结合发挥治疗作用,但可成药的靶点蛋白数量有限。自上世纪80年代后,基于靶点的新药研发逐渐展开,并发现了大量的新药;传统的小分子化药和抗体药物均是通过与靶点蛋白结合而发挥药理作用,靶点蛋白可以是酶、受体、离子通道等。
尽管小分子化药有易生产、可口服给药、药代动力学性质更佳、易通过细胞膜等优势,但是其研发受到靶点可成药性(druggable,与靶点蛋白是否有合适的口袋结构、大小、深浅、极性等有关)的限制;据Nature 2018的一篇文章报道,人类基因组编码的~20,000种蛋白质中,仅有3,000种是可以成药的,且只有700种有相应的药物研发出来(以小分子化药为主)。
注:GPCR, G protein-coupled receptor;1包括40种转录因子;2不包括激酶
Tclin蛋白:与至少一种已获批药物相关联的药物靶点
Tchem蛋白:确认与小分子结合具有高亲和力
Tbio蛋白:对其具有一定的生物学理解水平,但缺乏小分子结合物
Tdark蛋白:对其特征理解非常有限
同时,抗体类药物可作用的靶点位置受到限制。在小分子药物之后,以抗体药物为主的生物药逐渐出现,与小分子化药相比,抗体药物可作用的靶点蛋白种类更多,且可通过蛋白质工程技术提升其亲和性降低毒性等。但是抗体类药物拥有分子结构更加复杂、生产成本更高、通常需通过注射给药等劣势,并且抗体药物通常只能与细胞膜表面或细胞外的蛋白质发挥作用,使得其应用受到一定限制。
相比之下,核酸类药物拥有明显的优势。核酸类药物可基于碱基互补原理对表达相关蛋白质的基因进行调节,如ASO、siRNA、miRNA、saRNA等,而非与靶点蛋白质进行结合,且通过合适的递送系统可使其进入细胞内发挥作用,因此核酸药物可避免传统小分子化药和抗体类药物面临的不可成药靶点的限制问题,而且对胞内外和细胞膜蛋白均可发挥调节作用。
另外,多数核酸类药物的作用基础是碱基互补配对原则,只需知道靶基因的碱基序列,核酸药物的序列设计就十分容易,化学修饰和递送系统的设计与序列的设计是相对独立的;相比之下,小分子和抗体药物的发现和优化过程中,对活性、PKPD等性质的优化均需要对结构做改动,需要花费大量的工作。
核酸药物递送是研发的难点
但是核酸药物多年来发展曲折,在核酸药物的开发领域主要面临三大问题:
1.核酸分子,特别是RNA在体内不稳定性;
2.潜在的副作用;
3.药物递送系统(DDS)的困难等。
也就是说,核酸药物富有挑战的是其注射进入人体后,如何存留足够时间以准确靶向到病变部位,同时避免损伤正常细胞,归根结底是研发出高效安全的药物递送系统,以解决核酸药物递送、稳定性、脱靶效应等难题。
但随着新技术的发展,部分难题已经有较好的解决办法,其中化学修饰和递送系统技术的突破对核酸药物的发展起到了至关重要的作用。尽管化学修饰可以改善核酸药物的稳定性和免疫原性,核酸药物需进入细胞内才可以发挥作用,由于核酸药物分子量较大且通常带负电荷,因此被细胞摄取的效率和内吞体逃逸的效率比较低,因此需借助递送系统的力量。
递送系统可分为病毒载体和非病毒载体,病毒载体在基因治疗中应用较多,但由于其免疫原性、致瘤性、和有限的载药量(loading capacity)使得其在核酸药物中应用相对较少;而非病毒载体应用相对更多,如聚合物类(polymer)、脂质类(liposome 或 LNP);且可以将核酸药物与特定的配体结合使其能够靶向特定的细胞,如 GalNAc、多肽、抗体等。
目前常有的递送方案包括:纳米脂质体、阳离子聚合物、GalNac糖基化修饰等。未来,这一领域的发现将会有力的推动核酸药物的发展。
脂质类是目前核酸药物中研究应用最多的递送系统之一,且已经有使用脂质纳米颗粒递送系统的核酸药物获批,根据其性质和结构的不同其可以分为脂质体(liposome)、脂质纳米颗粒(LNP,lipid nanoparticle)等,目前研究中用的较多的包括含有可离子化脂质的LNP等。
聚合物类递送系统也常用于药物递送,阳离子聚合物可中和核酸药物的负电荷以提升进入细胞的效率,聚合物可以进行多种化学改造,而且可以与多种药物或配体兼容(compatibility)。聚合物可以做成线状或分枝状,PEI(polyethyleneimine)被应用于siNRA药物的递送。
尽管脂质类递送系统促进了核酸药物的发展,脂质类递送系统体积较大,更容易进入肝、肾的空隙较大的组织,且依然会有免疫原性,有时需与糖皮质激素类药物同时使用。核酸偶联递送是指将核酸药物与递送材料偶联,如胆固醇、多肽、抗体、核酸适配体或小分子结构等,利用递送材料的性质将核酸药物送至细胞内。
GalNAc是目前常用的核酸偶联递送系统之一。与脂质类载体相比,核酸偶联物分子量相对较小,因此体内生物分布的性质更佳,而且通过偶联物的设计可以使其靶向特定的组织和细胞,同时采用对酸敏感的linker设计可以使核酸偶联物在通过内吞体进入细胞之后与偶联物脱离。其中GalNAc是目前应用较为成功技术之一,已经有3款基于GalNAc技术的核酸药物获得FDA或EMA的批准。
相关企业
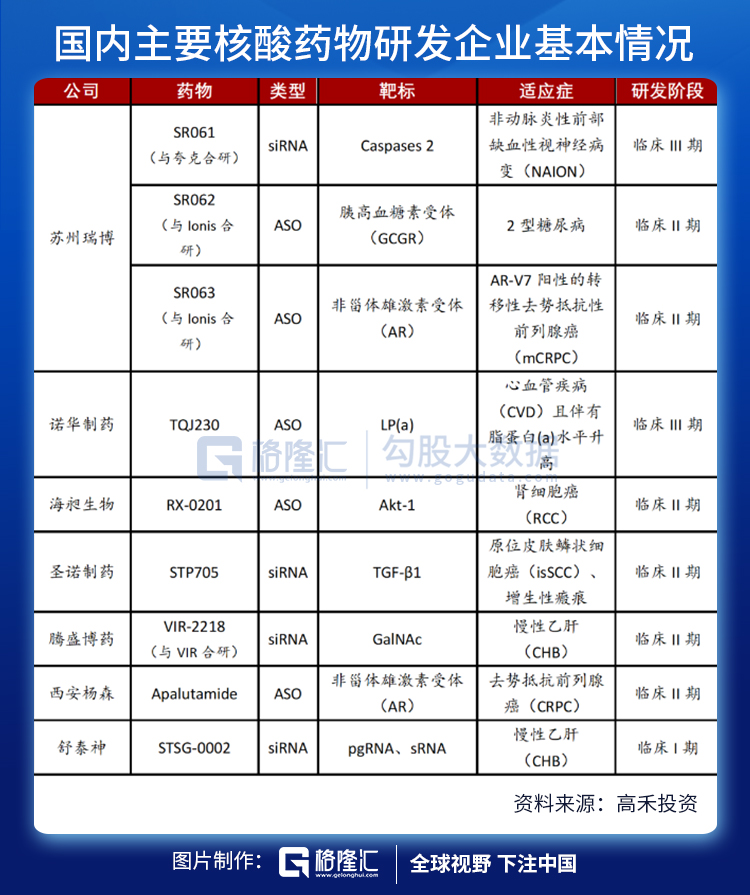
尽管国外核酸药物领域如火如荼,国内由于技术的限制,涉足核酸药物的公司屈指可数。据统计,截至2021年7月1日,国内药企研制的小核酸药物项目IND已获批并进入临床阶段的共有9个,其中5款ASO药物,4款siRNA药物,涉及的疾病领域包括抗病毒、代谢性疾病和心血管疾病等。
药物公司包括瑞博生物、圣诺制药、天龙药业、中美瑞康、斯微生物、彭济凯丰、西安荣清畅、复星医药、舒泰神、绿叶制药、香雪制药、艾棣维欣、美诺恒康、步长制药。
CRO/CDMO包括吉凯基因、吉玛基因、锐博生物、百奥迈科等。
本文来自微信公众号 “格隆汇研究”(ID:glh_tushuocaijing),作者:东北一度,36氪经授权发布。