36氪首发 | 通过新生抗原筛选实现肿瘤个性化治疗,「格源致善」获千万元级天使轮融资
36氪获悉,专注于个性化肿瘤疫苗研究和应用的生物科技公司格源致善已完成千万元天使轮融资,资方为合力投资。据悉,这笔资金将主要用于临床申报和系统搭建等方面。
在肿瘤治疗方面,免疫疗法是当前的大热门,这几年大家熟悉的免疫治疗方法有Car-T和PD-1/PD-L1等,但前者只在血液肿瘤中效果好,研究发现复发率很高,在实体肿瘤中的效果和安全性也有待进一步验证;后者指代的免疫监测点阻断治疗只在20-30%的患者中有效。
个性化肿瘤疫苗是最新的一种免疫疗法,它能根据患者自身肿瘤基因突变去设计个性化疫苗,激发主动免疫反应进而杀伤肿瘤。因针对目标是肿瘤突变产生的新抗原,个性化肿瘤疫苗具有准确杀伤、副反应小的特点。
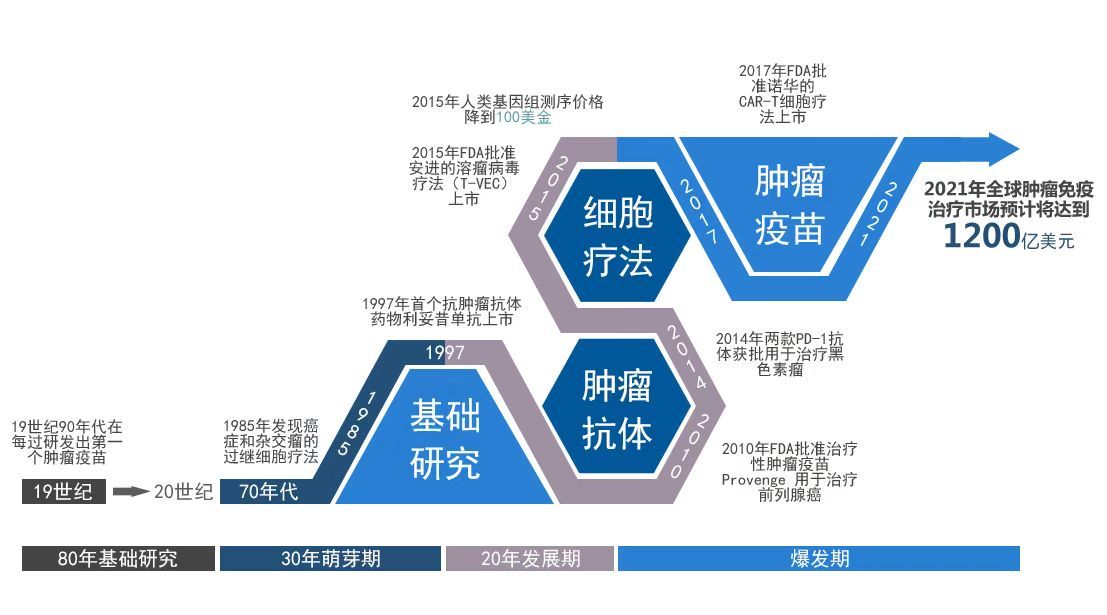
其实,肿瘤疫苗不是新鲜事物,人类研究它已经超过30年。其中最大的难点在于对于MHC有高亲和力的肿瘤抗原的筛选。随着高通量测序技术的成熟及免疫学的进步,肿瘤新生抗原的高效筛选有了实现的可能。2017年7月,Nature发表了两项个性化肿瘤疫苗的临床I期试验,均是基于测序结果筛选肿瘤新生抗原进行疫苗构建,实现了该领域的重大突破。
个性化肿瘤疫苗研究的历史进程(团队供图)
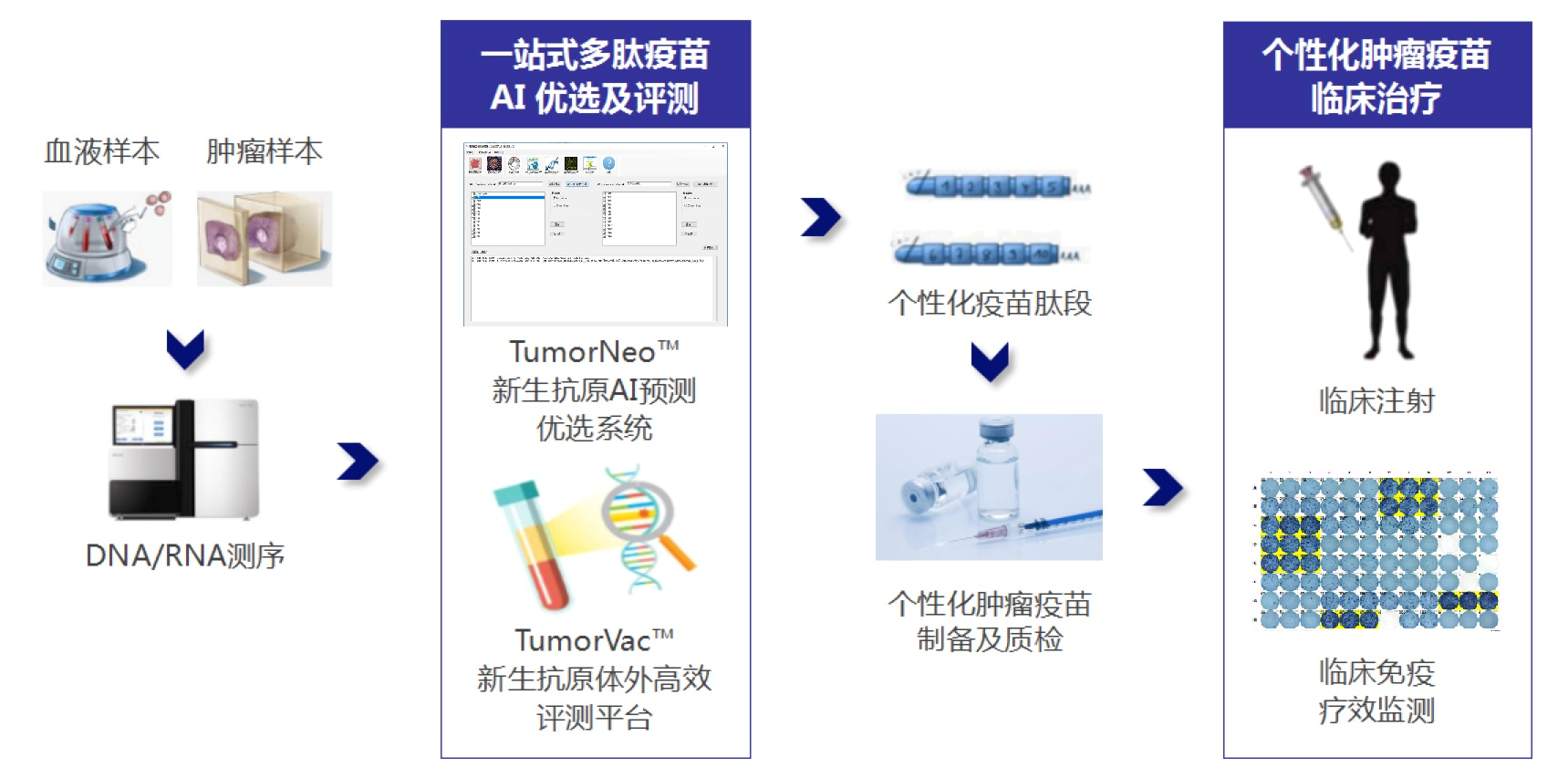
据创始人苏小平博士介绍,格源致善开发出TumorNeoTM新生抗原优选平台,通过神经网络算法同时检测多种突变产生的变异肽段,基于肿瘤突变产生的变异肽段预测以上变异肽段与MHC I和MHC II的亲和力,再结合中国人群肿瘤新生抗原数据库预测和筛选出高质量肿瘤新生抗原序列。
苏小平博士认为,尽管目前个性化肿瘤疫苗的发展步伐还落后于免疫检查点抑制剂和Car-T治疗,但有了肿瘤新生抗原预测技术作为翅膀,有望实现弯道超车。
但在个性化基础上,新抗原合成的有效性、安全性也至关重要的,若使用前不能对其进行快速准确地评测,或使用后不能对患者快速准确地监测,个性化疫苗的应用前景也会大打折扣。 基于此,格源致善还开发了TumorVac™新生抗原体外高效评测平台。该平台由T细胞体外诱导体系、人源化PDX小鼠评测体系和细胞单MHC亲和力评测体系三套系统构成,以确保肿瘤新生抗原的安全性和有效性。
筛选和评估流程(团队供图)
研究进展方面,据苏小平介绍,公司和上海、浙江、福建等多家三甲医院的联合临床研究均已正式启动,已通过针对肺癌、肝癌、胆管癌等多个癌种的临床伦理批件,正开展临床试验研究,并完成数十位患者入组,正开展个性化肿瘤疫苗回输治疗的患者有10个;体外评估方面,也正在开展消化道肿瘤、宫颈癌、难治性乳腺癌等肿瘤的体外个性化疫苗评估,同时还与全球知名的I-O药企进行联合治疗,相关的临床试验也即将开始。在未来的落地应用上,苏小平博士表示,会开展CRO服务或开发自己的临床检测产品。
不过,他也坦言,个性化免疫治疗技术路线固然很清晰,但其中还涉及到多个难点比如肿瘤原发灶和转移灶的区别;另外因涉及测序(数据海量)、质控、合成等多个步骤,新生抗原的筛选和制备周期目前还很长。基于此,格源致善接下来在优化系统之余也会自己介入测序和多肽准备环节,以压缩时长。
在肿瘤新生抗原预测领域,目前国内玩家并不多,仅有裕策生物、安诺基因等少数几家浮出水面。公开资料显示,前者新生抗原检测技术TrueNeon经过了TESLA联盟的全面验证,但尚未开启临床试验;后者基于DNA和/或RNA测序数据,能鉴定并注释肿瘤体细胞突变和/或融合基因,并利用多种机器学习方法进行新生抗原预测,目前也处于起步阶段。另外,国际上知名的肿瘤个性化疫苗公司Neon Therapeutics也只进展到临床2期阶段。
团队方面,格源致善主要由免疫学家、临床肿瘤学家、临床免疫治疗专家、生物信息专家组成。创始人兼CEO苏小平博士曾师从著名免疫学家曹雪涛院士,负责开发个性化肿瘤疫苗数据分析系统、体外评估系统;临床肿瘤专家李文峰教授为温州医科大学附属第一医院放化疗科主任医师、硕士生导师,温州551第二类人才计划成员,负责个性化疫苗临床研究方案设计;临床免疫治疗专家孙伟红教授为医学免疫学国家重点实验室博士,浙江大学博士后,负责个性化疫苗体外评估系统建立;生物信息专家、肿瘤免疫学专家刘小龙教授为美国布朗大学博士,后在美国布朗大学和瑞士巴塞尔大学生物中心进行博士后训练,负责个性化疫苗数据分析及预测系统研发;负责临床实验督查质控的苏娟教授,是原第二军医大学基础医学部副教授,长期研究细胞生物学。