创投观察 | 微生物组治疗:资本持续押注,多方角力谁将率先突围?
本文是创投观察系列的第 188 篇
分享人:BioX-Ray
编辑:菜菜
本文来自微信公众号“生物制药小编”,36氪经作者授权发布。
微生物组产业风向:资本持续押注治疗领域
近几年来,基于微生物组学的药物开发和基因检测得到空前发展,建立了多种疾病与微生物组学之间的关系。基于人体微生物组开展疾病的治疗,又被称作微生物组疗法(Microbiome therapeutics)。
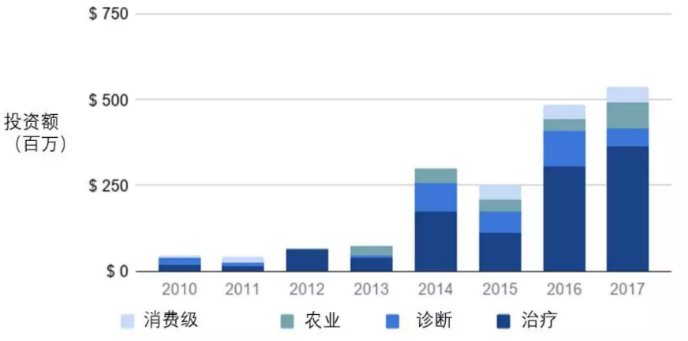
作为一个全新的治疗模式,其广阔的市场前景和坚实的科研基础吸引了大量的资金,根据Global Engage的统计数据,2010年至2017年,近18亿美金的风投资金(种子轮到C轮)涌入微生物组产业(图1),治疗、诊断、农业及消费级四个应用领域中,微生物组治疗成为投资热土,吸纳了总投资额的61%。
图1 2010-2017全球微生物投资领域及金额分布(数据来源:Global Engage)
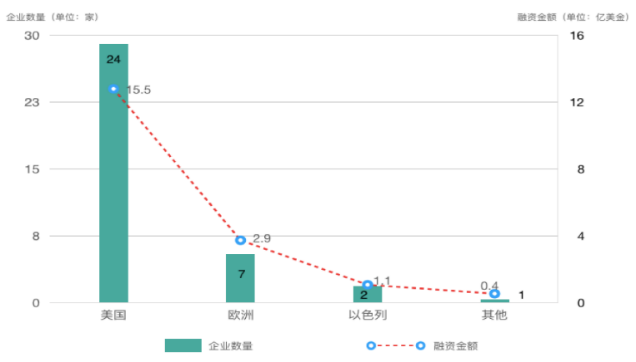
图2 治疗领域初创企业地区分布及融资额(截至2019年,数据来源知几未来研究院[1])
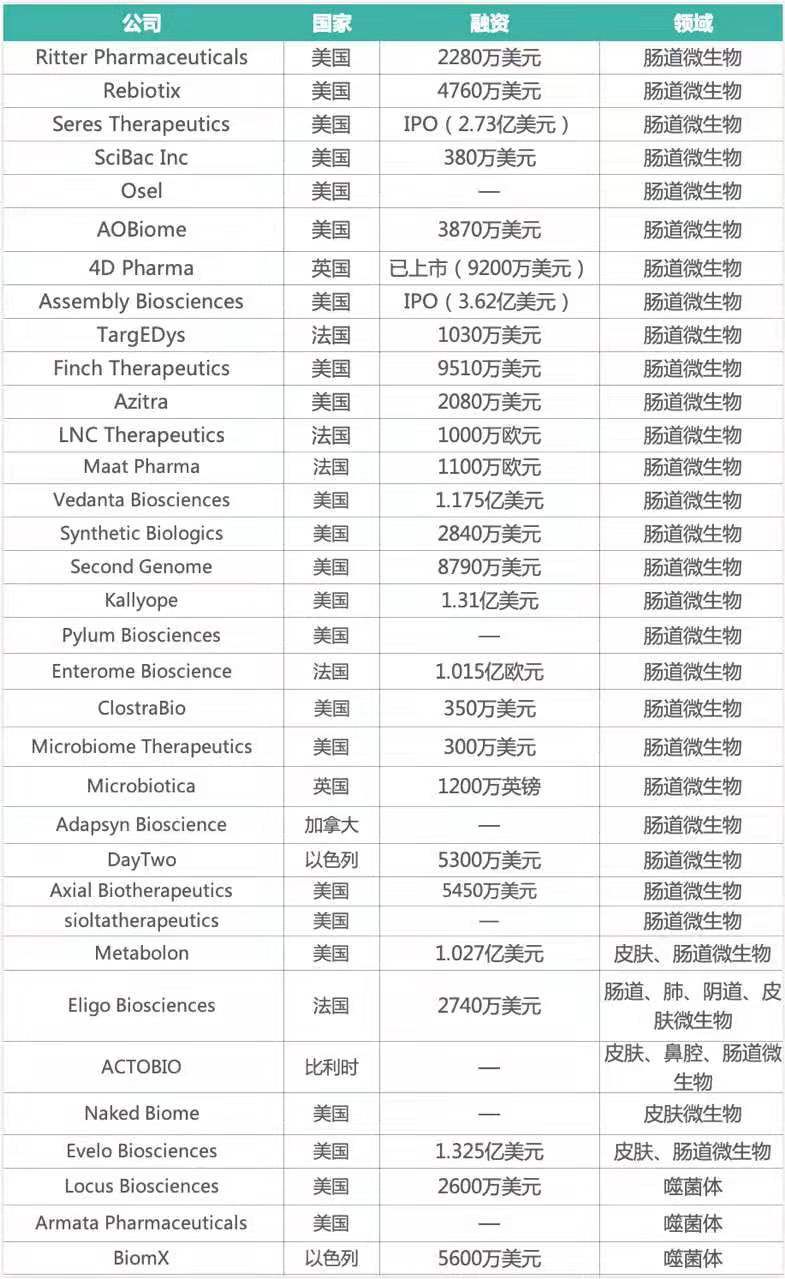
就在今年,又有近10亿美元资金投入了Finch Therapeutics、Vedanta Biosciences、Azitra、Biomx等治疗领域初创企业。知几未来研究院[1]统计了治疗领域全球知名的34家企业,发现治疗型企业主要分布在美国、英国、法国及以色列(图2),其中尤以美国为多(24家),欧洲其次(7家),且90%以上聚焦于肠道微生物组(图3)。
图3 治疗领域全球知名企业融资情况(共计34家, 知几未来研究院统计[1])
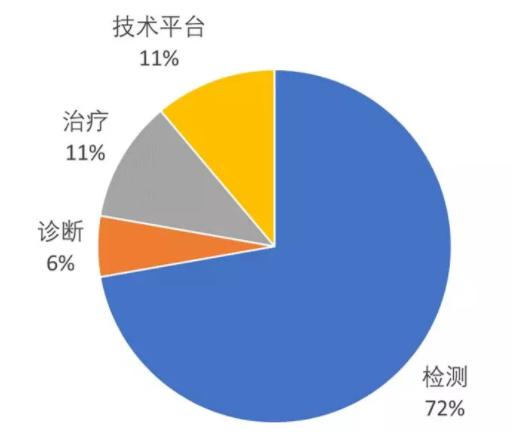
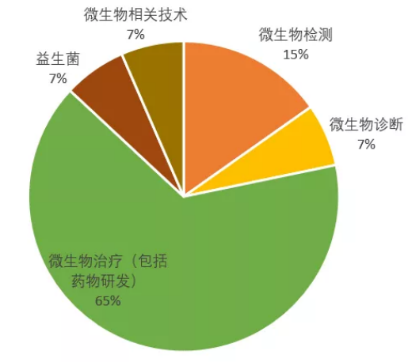
回望国内企业,领域上与国外尤其是美国相比呈现截然不同的分布。蓝色彩虹收集了2018年8月前创办且被报道过的人体微生物组企业,共18家国内公司和46家国外公司(美国36家,欧洲9家,加拿大1家)[2]。国内企业中,13家(72%)布局检测,主要提供科研服务或者基于肠道菌群检测的健康管理服务(图4);国外企业中,30家(65%)布局微生物治疗(包括药物研发),布局检测仅7家(15%)(图5)。
图4 国内微生物组企业业务领域分布
图5 国外微生物组企业业务领域分布
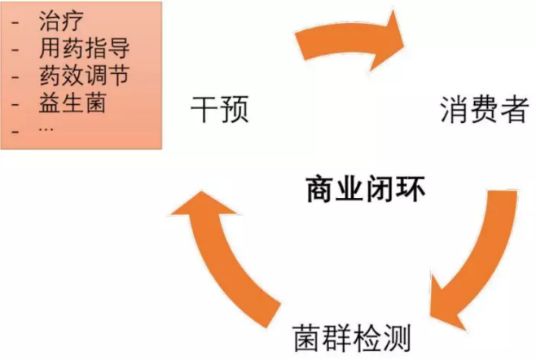
图6 人体微生物组商业闭环
从国内微生物组学产业发展当前的态势看,仅仅只做检测是不够的 (注:这里的检测不包括针对病原体的宏基因组检测),资本也不再盲目追求检测数据带来的想象空间。
唯有在检测后提供具备临床价值的干预手段,形成商业闭环(图6),才能提升消费体验,推动检测需求与产业的有机发展,而药物作为最直接的治疗手段,从微生物组切入疾病治疗,也是国外企业布局最多的领域;除此之外,从肠道微生物组入手、围绕免疫治疗的药效调节也是一个具有广阔市场前景的干预场景[3]。
自2003年美国Osel作为第一家获得FDA授权的企业进行其活性生物治疗临床测试以来,34家布局治疗领域的企业(图3)融资总额已逾19亿美元,推动着上百个管线的开发,然而现实却显得有些骨感:该领域仍然没有一款药物或疗法成功获得FDA批准上市。
活性生物治疗起步最早,暂时领跑
微生物代谢产物一直是现代创新药物发现的重要来源,有别于微生物次级代谢产物来源的微生物药物(如抗生素),微生态药物是近几年才出现的概念。
中国科学技术信息研究所的贾晓峰研究员在其《国际人体微生态科技发展报告2017》中对微生态药物给出过这样的定义:利用微生物通过次级代谢产物等或者直接通过小分子等物质影响微生物群落,维持、重建或恢复健康的人体微生态平衡体系,进一步治疗相关的疾病,主要可分为活体生物治疗(LBP)、粪菌移植(FMT)、小分子和生物制剂、噬菌体四类方法[4]。
从关键词可以看出,其治疗落脚点是重构人体微生态平衡。其中,活性生物治疗是通过将一种或多种菌株体外培养后定植于肠内、作为“有益菌”发挥治疗功能,其出现最早、发展时间也最长;而小分子药物和生物制剂则通过影响人体微生物组的构成或微生物组与宿主之间的代谢互作、信号转导来发挥治疗作用;后者正在越来越多地改变当前微生物组疗法的面貌。
关于活体生物疗法(Live Biotherapeutic Preparation,LBP)FDA官方给出了如下的定义:指从人体(供体)微生物菌群中分离出来,以人源微生物(微生物整体或部分实体,如菌苗、类毒素、抗毒素、抗血清、血清、毒素等,不包含疫苗)为主要成分,通过鉴定、分类、培养、组合等形式制备的、用于预防、治疗人类疾病或症状的非注射、口服类生物制品。界定是否属于“LBP”,FDA认为一个重要的标志就是“是否含有活的有机体”。
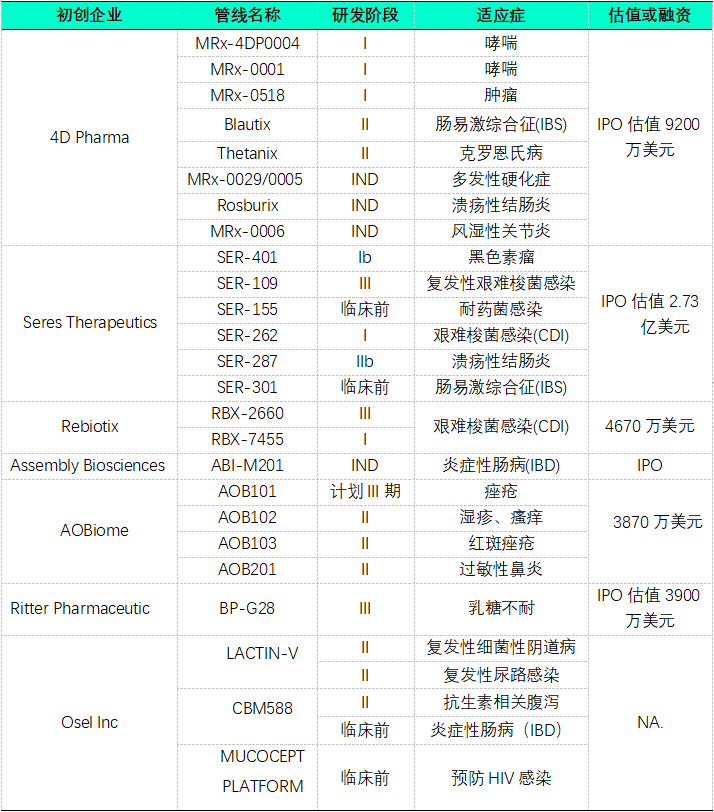
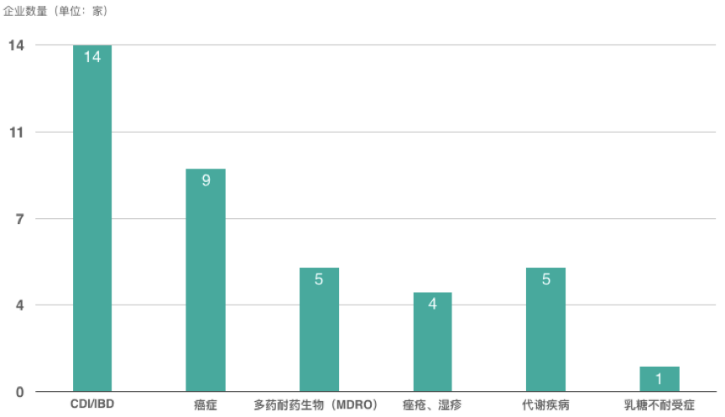
与粪菌移植不同,LBP针对不同的适应症可采用不同种类、不同数量的微生物或其组合,从而保证治疗的安全性和有效性。当前,近半数微生物组初创企业布局LBP(图7仅例举部分),CDI和IBD则是最普遍的两种适应症(图8)。
图7 部分企业活体生物治疗管线布局(数据来源各企业官网及IPO招股书)
图8 34家初创企业适应症布局一览(数据来源:知几未来研究院)
正如中国科学技术信息研究所贾晓峰研究员曾指出的,与其他药物相比,活体生物治疗面临着人体共生微生物的相互作用解析以及难以标准化的问题[4],近期更有疗法折戟III期,总体上看,目前仍处于起步阶段,能否利用好先发优势率先突围仍需行业加大探索力度。
小分子药物,后起之秀能否后发先至?
相较于活性生物治疗,微生物组小分子药物则有着成分单一、开发更简化、监管路径更明确的优点。除了大热的与免疫疗法的协同外,在预防CDI、IBS,治疗银屑病、类风湿关节炎、特应性皮炎和哮喘以及神经性疾病等诸多领域,微生物组小分子药物也具有良好的疗效,尽管大部分管线仍处于早期阶段。
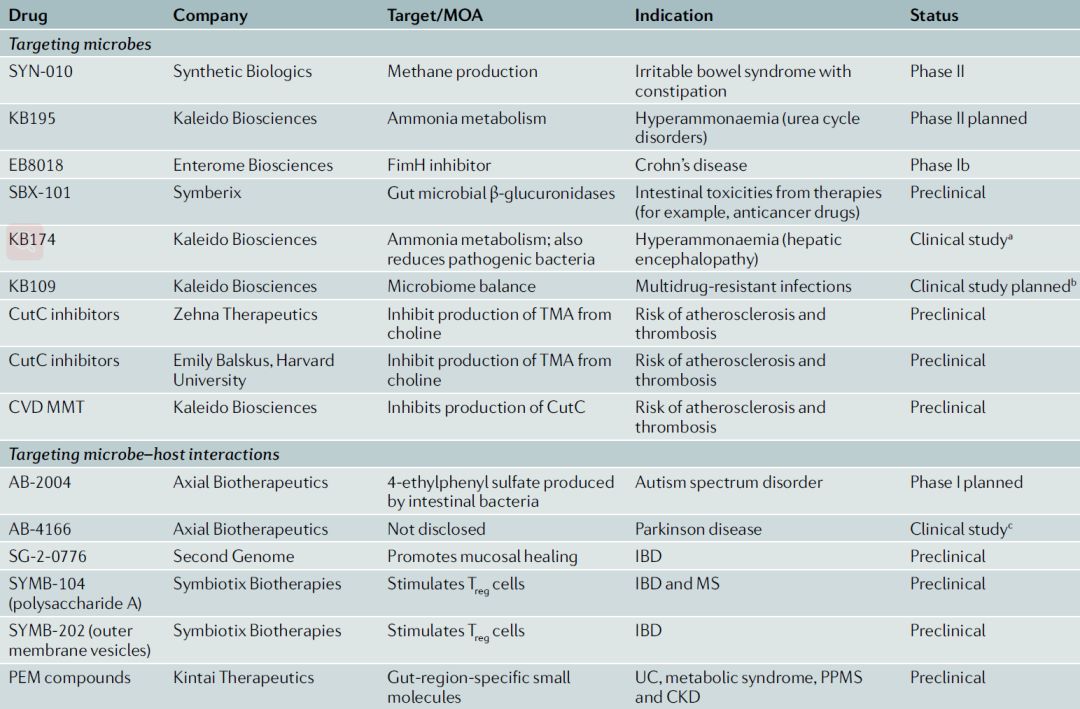
今年8月的Nature Review刊发了资深编辑Megan Cully的一篇综述《Microbiome therapeutics go small molecule》[5][6],对小分子药物开发的最新进展进行了总结。文章提到虽然进入治疗领域的大多数公司仍聚焦于开发活性生物治疗,而Second Genome及其他数十家公司则致力于开发小分子药物和生物制剂,管线中亦不乏进入II期临床的项目(图9)。
Cully总结的小分子药物和生物制剂的治疗路径主要包含以下几个方向:
(1) 抑制特定微生物在肠道的定植:治疗炎症性肠病(IBD)患者的主要手段是使用降低肿瘤坏死因子(TNF)的药物,以期减少炎症反应。但TNF并不是导致IBD的主要原因,减少TNF并不能起到根本性的作用。
由于在临床上观察到一些IBD患者的肠道中具有黏附-侵入性的大肠杆菌大量增加,因此研究者认为阻止此类“有害”细菌与肠上皮的结合能力可能会成为治疗IBD的一种方法。Enterome Bioscience开发了一款菌毛黏附素(FimH)的抑制剂——EB8018,期望通过抑制FimH降低恶性细菌在肠道内的定植能力,从而减轻炎症。目前,EB8018正在临床Ib期实验中。
(2) 调控微生物组代谢活动:作为一款来源于霉菌代谢产物的经典小分子药物,洛伐他汀是一类靶向人类HMG-CoA还原酶的药物(HMG-CoA还原酶也是肝脏中胆固醇合成通路的限速酶之一),与此同时,洛伐他汀还可以结合并抑制古细菌F420依赖的Mtd酶。这是一种由肠道定植微生物表达的产甲烷的酶,而甲烷的产生极易引起腹胀。
根据洛伐他汀这一特性,Synthetic Biologics研发了洛伐他汀改良释放的前体药物SYN-010,使其仅在肠腔中释放,并递送至表达Mtd的古细菌处以减少甲烷产生,缓解便秘型肠易激综合征患者的疼痛性腹胀。目前,该药物正在进行临床II期实验,预计将于2020年初得到结果。
(3) 调节微生物组成分的活性:Kaleido Biosciences通过对人体微生物组进行表型筛选,发现了多糖可能改变细菌氨产生的现象,并基于此开发了一款先导候选药物KB195,虽然具体的机制尚不清楚——KB195有可能导致细菌将氨作为食物来源或者打破了细菌氨吸收和氨产生之间的平衡。
临床数据显示,其能够降低高蛋白饮食的健康人的的氮代谢水平,而氮代谢水平正是氨产生的标志物。目前,KB195用于治疗高氨血症(一种由尿素循环失常而引起的代谢紊乱)的II期临床试验即将开始。
(4) 阻止微生物对失活药物的再激活:伊立替康是一种抗肿瘤的化疗药物,通过静脉给药在体内转化为活性形式,然后在肝脏中失活并通过胆管排出,但肠道中细菌产生的β-葡萄糖醛酸酶可以在药物通过时重新激活药物,导致肠道损伤和腹泻。
北卡罗来纳大学的化学家Matt Redinbo发现在小鼠中抑制β-葡萄糖醛酸酶的活性可以防止药物的再激活及化疗药物的相关副作用,基于此他开发了一款β-葡萄糖醛酸酶的抑制剂SBX-101。目前,SBX-101还在进行临床前研究。
(5) 调控肠道微生物代谢治疗神经性疾病:加州理工学院的Sarkis K. Mazmanian实验室发现患有自闭症谱系障碍(ASD)、抑郁症、精神分裂症和帕金森病(PD)的患者相比正常对照具有不同的肠道微生物群落。将来自自闭症患者的肠道菌群移植到无菌小鼠后,无菌小鼠及其后代出现了自闭症的核心行为学表型,还导致了小鼠的大脑中自闭症相关基因出现异常。
通过微生物组及代谢组学分析发现,特定类型的微生物及其代谢产物是引发小鼠行为异常的关键,部分代谢产物可明显改善自闭症小鼠模型的行为学异常并调节大脑的神经兴奋性。基于上述发现,Axial Biotherapeutic正在开发小分子化合物来改变特定细菌代谢产物的产生和吸收。
由于在临床观察中发现ASD患儿血液中有高水平的4-乙基苯基硫酸盐(4-EPS),Axial Biotherapeutics于是针对性地开发了能降低小鼠血液中细菌代谢物4-EPS含量的先导化合物AB-2004。目前,该化合物正在ASD青少年中筛选受试者进行Ib / IIa期临床试验。
(6) 微生物代谢物影响心血管功能:众所周知,饮食对心血管健康的影响是非常重要的。目前,饮食干预疗法仍然是高胆固醇血症,高甘油三酯血症和其他心血管疾病治疗的主要手段,其中一种常见的饮食建议就是令患者减少摄入肉类,蛋黄和高脂肪乳制品。
最新的研究表明,这些食物影响疾病的原因可能是因为它们都含有高丰度的胆碱。胆碱作为一种人体必需的营养元素,会被肠道细菌代谢成三甲胺(TMA),TMA在肝脏中进一步代谢成三甲胺N-氧化物(TMAO),已有报道提示体内高循环水平的TMAO与心血管风险事件增加有关。去年克利夫兰医学中心的Stanley Hazen在Nature Medicine上报道:细菌酶胆碱TMA裂解酶(CutC)的小分子抑制剂可以降低小鼠的循环TMAO水平,相应地降低血栓形成的潜在风险。
由于TMA几乎全部由微生物产生,因此包括Zehna Therapeutics(由Hazen与克利夫兰医学中心联合创立)、Kaleido Biosciences和哈佛大学化学家Emily Balskus在内都十分看好抑制CutC的治疗潜力,正在大力开发CutC小分子抑制剂。目前,这些CutC的小分子抑制剂都还处于临床前研究阶段。
图9 部分初创企业微生物组小分子药物在研管线
除上述的开发方向外,微生物组与免疫治疗(ICI)之间的协同绝对是当前基础研究的热点和各家初创企业的“必争之地”。JnJ、AstraZeneca、MSD、Pfizer、BMS等一批药企巨头纷纷押注微生物组初创药企,看重的也是微生物组小分子在提升免疫治疗抗肿瘤疗效中的潜在能力。
截至目前,对特定肠道菌群的存在与疾病之间的关联进行功能验证的研究集中于对ICI有响应的患者以及肥胖、2型糖尿病和接受过胃旁路术的患者[7]。
从2015年Science杂志上两篇研究首次确认肠道微生物能够影响ICI疗效,到2017年下半年Zivogel团队发现使用nivolumab前后2个月内接受过抗生素治疗的NSCLC患者,PFS和OS几乎相差一倍,进而对患者的粪便样本进行测序发现对nivolumab响应良好的患者样本中有Akkermansia muciniphila(Akk菌)的富集[8],越来越多的研究证明对ICI有响应的患者肠道微生物中存在优势菌种,且不同癌种和ICI治疗方案之间优势菌种并不相同。
Cully对该细分领域的药物开发现状也作了梳理,总结了三个方面的治疗机理:1) 干扰微生物与宿主间的炎症反应;2)补充缺失的细菌分泌蛋白;3)调控免疫细胞控制局部炎症。如Symbiotix Biotherapies发现的候选物SYMB-104——一种可被树突状细胞吸收并带往远端炎症部位的两性离子荚膜多糖,能将天然T细胞转化为调节性T细胞(Treg)从而抑制局部炎症反应。篇幅所限,该细分领域就不展开了。
虽然我们看到越来越多的微生物组调节小分子和生物候选物正在接近临床,但毋庸置疑,该领域仍处于起步阶段;与此同时,各家初创企业之间还没有拉开明显差距,且各家选择的疾病领域和治疗路径也不尽相同,但殊途同归,谁率先完成临床试验并最终将微生物组疗法运用于临床,谁就将成为微生物组治疗领域的“游戏规则改变者”。那有没有什么“外力”可以助推整个领域研发总成功率的提升呢?就此问题作者采访了Second Genome的CSO,Karim Dabbagh博士,他给出了这样的回答:
“测序、代谢组学技术以及计算生物学方法已经在推动该领域前进的正确方向上,并且速度很快;但是我们所感兴趣的疾病领域内、既有纵向的观察取样又有完整的宏基因组、饮食、疾病史等荟萃数据的临床微生物组样本的缺乏,又阻碍了其前进的步伐。”
当下的微生物组有点像处于20年前测序人类基因组的那个时代,随着对人类第二基因组研究的愈发深入,一旦将微生物组的诸多问题搞清楚后,药物化学家将会有大量的微生物来源的先导小分子作为候选。
参考文献:
[1] 知几未来研究院公众号文章《几家欢喜几家愁,百亿微生态药物产业的沉与浮》,发表于2019年10月30日
[2] 蓝色彩虹公众号文章,《肠道微生物(一)- 肠道微生物产业热度不减,中外产业发展差异明显》,发表于2018年12月10日
[3] 蓝色彩虹公众号文章,《人体微生物(二)-产业发展遇阻力,形成干预是关键》,发表于2019年3月29日
[4] 中国科学技术信息研究所,贾晓峰《国际人体微生态科技发展报告2017》http://blog.sciencenet.cn/blog-786113-1101311.html
[5] Cully M. Microbiome therapeutics go small molecule. Nat Rev Drug Discov, 2019
[6] 分子设计公众号文章《微生物组调控的小分子药物时代》,2019年8月发表
[7] Cani P D, Human gut microbiome: Hopes, threats and promises, Gut, 2018
[8] Routy B, et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science, 2018.